-
某溶液X中可能含有下列离子中的若干种:Cl-、SO42-、SO32-、HCO3-、Na+、Mg2+、Fe3+,所含离子的物质的量浓度均相同。为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如下实验:
(1)向溶液X中加入足量的Ba(OH)2溶液,得到白色沉淀:
(2)将(1)的反应混合液过滤,将足量盐酸加入沉淀中,沉淀部分溶解且产生气体。
下列说法正确的是
A. (2)中产生的气体可能CO2或SO2
B. 溶液X中一定存在SO42-、HCO3-、Mg2+
C. 溶液X中一定不存在Fe3+,可能存在Cl-
D. (1)中产生的白色沉淀一定含有BaSO4,可能含有BaSO3
难度: 困难查看答案及解析
-
常温下,下列说法正确的是
A. 0.1mol·L-1醋酸溶液与等浓度等体积的氢氧化钠溶液混合后,c(H-)>c(OH-)
B. 常温下,0.1 mol·L-1的盐酸和醋酸溶液的导电能力相同
C. 常温下,pH均为11的NaOH溶液和氨水中由水电离产生的c(OH-)均为1×10-11mol·L-1
D. 足量的锌分别与等体积的盐酸(pH=1)和醋酸(0.1 mol·L-1)反应,收集到相同条件下的气体体积不相同
难度: 困难查看答案及解析
-
下列属于碱的是
A. Na2CO3 B. HClO C. CuO D. Ca(OH)2
难度: 中等查看答案及解析
-
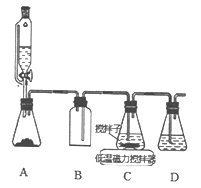
仪器名称为“容量瓶”的是
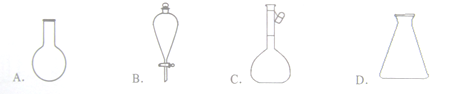
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列属于电解质的是
A. 蔗糖 B. 硝酸钠 C. 氨气 D. 镁条
难度: 中等查看答案及解析
-
下列反应中,HC1作还原剂的是
A. Fe+2HCl=FeCl2+H2↑ B. Na2O+2HCl=2NaCl+H2O
C. Mg(OH)2+2HCl=MgCl2+2H2O D. MnO2+4HCl(浓)
MnCl2+Cl2+2H2O
难度: 简单查看答案及解析
-
下列物质的水溶液因水解呈酸性的是
A. NaHSO4 B. NaHCO3 C. NH4Cl D. SO2
难度: 中等查看答案及解析
-
下列过程会释放出热量的是
A. 浓硫酸稀释 B. 水的分解 C. 硝酸铵溶于水 D. 冰的融化
难度: 中等查看答案及解析
-
下列表示正确的是
A. HCl的电子式:
B. 乙炔的结构简式:CHCH
C. 水分子的比例模型:
 D. 质子数为6,中子数为8的核素:
D. 质子数为6,中子数为8的核素:C
难度: 中等查看答案及解析
-
下列说法正确的是
A. 常温下铁与浓硫酸不反应 B. 钠与氧气反应的产物与反应条件无关
C. 漂白粉暴露在空气中会变质 D. SiO2属于酸性氧化物,可与水反应得硅酸
难度: 中等查看答案及解析
-
下列说法不正确的是
A. CO2可作为镁带燃烧的灭火剂 B. 小苏打可用于焙制糕点
C. Cl2可用于自来水的消毒 D. 硅酸钠可作建筑业的黏合剂
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 新制氯水保存在棕色细口瓶中 B. 鉴别羊毛和棉花可用灼烧后闻气味的方法
C. 做焰色反应实验时,不能用铁丝代替铂丝 D. 可用l0mL量筒量取6.2mL的稀硫酸
难度: 中等查看答案及解析
-
下列说法正确的是
A. 35Cl2与37Cl2互称同位素
B. CH3CH2COOH 和 HCOOCH3互为同系物
C. 乙醛和环氧乙烷(
)互为同分异构体
D. 曾被广泛用作冰箱制冷剂的CHFCl2,其分子结构有两种
难度: 中等查看答案及解析
-
—定温度下,0.1molN2(g)与0.3molH2(g)在密闭容器中发生反应:N2(g)+3H2(g)
2NH3(g) △H=-akJ·mol-1(a>0)。下列说法正确的是
A. 达到化学平衡状态时,反应放出0.la kJ热量
B. 达到化学平衡状态时,v正(NH3):v逆(N2)=2:1
C. n( N2):n(H2):n(NH3)=l:3:2时,说明该反应达到平衡
D. 缩小容器体积,用氮气表示的反应速率:v正(N2)增大,v逆(N2)减小
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 用食醋除水垢的原理:2H++CaCO3=Ca2++H2O+CO2↑
B. 金属钠投入MgCl2溶液中:2Na+Mg2+=2Na++Mg
C. 0.1 molNaHSO4溶液和0.lmol·L-1Ba(OH)2溶液等体积混合: H++SO42-+Ba2++OH-=BaSO4+H2O
D. 碳酸氢氨溶液和足量氢氧化钠溶液反应:OH-+NH4+=NH3·H2O
难度: 中等查看答案及解析
-
下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法不正确的是
X
Y
Z
W
T
A. Y的位置是第3周期、第IVA族
B. Z、W、X的原子半径依次减小,非金属性依次降低
C. W的氢化物和X单质在一定条件下可发生置换反应
D. 根据元素周期律,可以推测T元素的单质具有半导体特性
难度: 中等查看答案及解析
-
下列说法正确的是
A. 丙烷与溴蒸气在光照条件下可发生取代反应
B. 苯在一定条件下能与氯气通过加成反应得到氯苯
C. 乙烯和裂化汽油均能使溴水褪色,其原理不相同
D. 煤中含有苯和二甲苯等物质,可通过煤的干馏获得
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 油脂皂化反应中加入乙醇的主要目的是增加反应物的接触面积,以加快反应速率
B. 在淀粉水解液中先加过量的氢氧化钠、再滴加碘水,溶液未变蓝,说明淀粉己经完全水解
C. 氨基酸分子中都含有-COOH和-NH2,在—定条件下,它们之间能发生反应生成高分子化合物
D. 游泳场馆常用硫酸铜溶液做池水的消毒剂,其原理利用蛋白质的变性
难度: 中等查看答案及解析
-
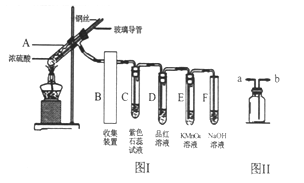
—种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示。下列有关该电池的说法不正确的是
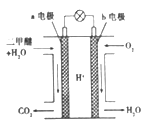
A. a电极是该电池的负极
B. b电极上发生的反应为:O2+4H++4e-=2H2O
C. H+由a电极向b电极迁移
D. 电池工作时,电子从a电极→灯泡→b电极→电解液→a电极
难度: 困难查看答案及解析
-
己知断裂lmolH2(g)中的H-H键需要吸收436kJ能量,断裂1molI2(g)中的I-I键需要吸收151kJ能量,生成HI(g)中的1 mol H-I键能放出299kJ能量。下列说法正确的是
A. lmolH2(g)和 lmolI2(g)的总能量为587kJ
B. H2(g)+I2(s)
2HI(g) △W=-11 kJ ·mol-1
C. HI(g)
l/2H2(g)+l/2I2(g) △H=+5.5 kJ·mol-1
D. I2(g)比H2分子稳定
难度: 中等查看答案及解析
-
下列说法正确的是
A. 某物质在熔融态钠导电,则该物质一定是离子化合物
B. 金刚石和C60熔化过程中破坏微粒间的作用力相同
C. 常温常压下,气态单质分子中,每个原子的最外层都具有8电子稳定结构
D. 液氯与水的反应需要克服分子间作用力和共价键
难度: 中等查看答案及解析
-
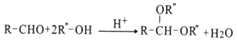
某化学小组为探究固体颗粒的大小对反应速率的影响,设计了下列实验:
称取5.00g均匀的块状大理石(含有SiC2等不与盐酸反应的杂质)与50.0mL2.00mol·L-1稀盐酸混合,测得实验过程中逸出气体的质量并记录(假设只逸出CO2);再称量5.00g大理石粉末,重复以上实验操作。实验数据汇总如图。
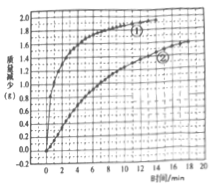
下列说法正确的是
A. 图中曲线①表示的是块状大理石与盐酸反应
B. 由图可知,如果等待的时间足够长,两条曲线应逐渐交汇
C. 大理石粉末与盐酸的实验中,0~8min内,盐酸的平均反应速率v(HCl)=1.64mol·L-1·min-1
D. 块状大理石与盐酸的实验中,13min时,CaCO3的消耗率为63.6%
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 2.24L甲烷气体中碳氢键的数目为0.4NA
B. lmolSO2与足量的O2反应,转移的电子数为2NA
C. 1 mol·L-1CH3COOH 与1 mol·L-1CH3COONa 溶液等体积混合,溶液中CH3COOH 和CH3COO-的总数为2NA
D. 7.8g乙炔与苯的混合物完全燃烧所消耗的O2分子数为0.75NA
难度: 困难查看答案及解析
-
25℃时,由酸(HM)及其盐(NaM)组成的混合溶液,起始浓度均为lmol·L-1。向该溶液中通入HC1气体或加入NaOH固体时,溶液pH的变化曲线如图所示。下列说法不正确的是
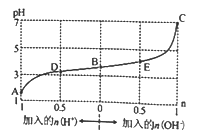
A. C点时,溶液中 c(Na+)=c(M-)
B. 将 D、E 点溶液混合后,c(M-)+c(HM)=2c(Na+)
C. B点时,溶液中 c(M-)>c(Na+)>c(HM)
D. A、B、C三点所表示的溶液中水电离出来的c(H+)逐渐增大
难度: 困难查看答案及解析
-
NaClO2广泛用于造纸工业、污水处理等,其漂白能力是漂白粉的4~5倍,工业上用C1O2气体制NaClO2的工艺流程如下:
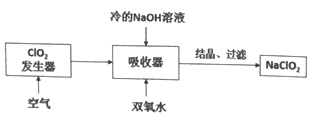
己知:NaClO2饱和溶液在低于38℃时析出NaC1O2·3H2O,高于38℃时析出NaClO2
下列说法不正确的是
A. 吸收器中生成NaClO2的离子方程式:2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O
B. 流程中的结晶、过滤操作应该是蒸发结晶、趁热过滤
C. 提高吸收器中的反应温度可以提高反应速率,也提高反应物的利用率
D. 发生器中反应结束后,向其中通入一定量空气的目的是驱赶出ClO2,使其被充分吸收
难度: 困难查看答案及解析
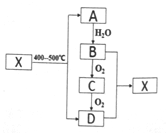
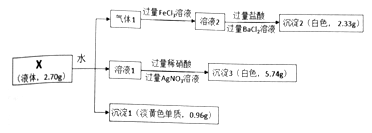
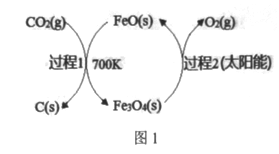

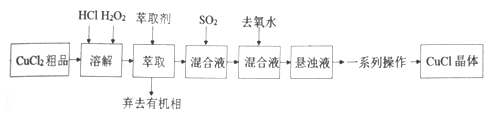
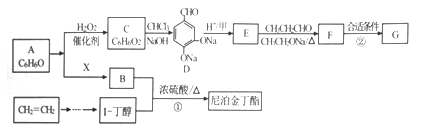
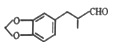 )的路线如下:
)的路线如下: