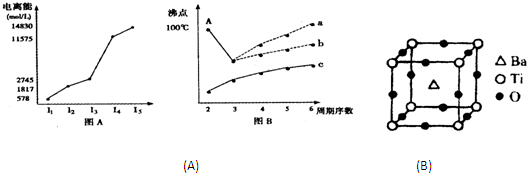
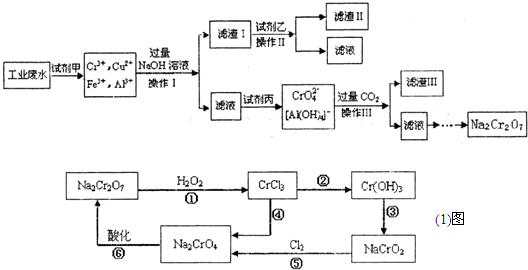
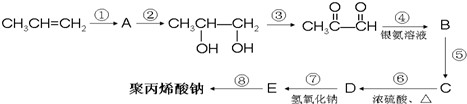
-
据国外有关资料报道,在独居石(一种共生矿,化学成分为Ce、La、Nd、…的磷酸盐)中,查明有尚未命名的116、124、126号元素.判断其中116号元素应为位于周期表中的( )
A.第6周期ⅣA族
B.第7周期ⅥA族
C.第7周期Ⅷ族
D.第8周期ⅥA族难度: 中等查看答案及解析
-
美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是( )
A.铝钠合金是混合物
B.铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na)
C.铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出
D.若mg不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小难度: 中等查看答案及解析
-
生活中常会碰到的某些化学问题,如:①“白雪牌”漂粉精可令所有有色物质黯然失“色”,没有最白,只有更白;②霸王洗发液不含任何化学物质;③人喝了啤酒会打嗝,是因为啤酒中的碳酸盐与胃酸反应生成了二氧化碳;④53度白酒是指该白酒的着火点是53℃;⑤太太口服液含丰富的氮、磷、锌等微量元素.则有关上述说法,你的看法是( )
A.全部正确
B.只有①⑤正确
C.只有③⑤正确
D.以上说法都是错误的难度: 中等查看答案及解析
-
食品保鲜的措施有:添加防腐剂、充填保护气体、放置干燥剂和脱氧保鲜剂等.一次,小明在食用盒装月饼时,撕开了用于保鲜的小纸袋,发现其中盛放着一种灰黑色的粉末,几天后,看到灰黑色粉末变得有些发红.原保鲜剂粉末可能是 ( )
A.木炭粉
B.铝粉
C.还原性铁粉
D.氧化铜粉末难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法正确的是( )
A.78gNa2O2与足量水反应中电子转移了2NA
B.只有在标准状况下NA个氧气分子的物质的量才是1mol
C.常温常压下,22.4LN2气体的分子数小于NA
D.20gD2O所含的中子数为9NA难度: 中等查看答案及解析
-
将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下.下列说法错误的是( )
物 质 a b c d 反应前质量/g 6.40 3.20 4.00 0.50 反应后质量/g 待测 2.56 7.20 0.50
A.a和b是反应物,d可能是催化剂
B.反应后a物质的质量为4.64g
C.c物质中元素的种类,一定和a、b二种物质中元素的种类相同
D.若物质a与物质b的相对分子质量之比为2﹕1,则反应中a与b的化学计量数(系数)之比为2﹕l难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.S02气体通入氯水中:SO2+2C1O-=2C1-+SO42-
B.将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O
C.向NaA102溶液中通入少量CO2:2A1O2-+CO2+3H2O=2A1(OH)3↓+CO32-
D.澄清石灰水与过量苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O难度: 中等查看答案及解析
-
某种混合气体,可能含有N2、HCl、CO.把混合气体依次通过足量的NaHCO3溶液和灼热的CuO,气体体积都没有变化;再通过足量的Na2O2固体,气体体积减小;最后通过灼热的铜丝,经充分反应后气体体积又减小,但还有气体剩余.以下对混合气体组分的判断中,正确是( )
A.一定有N2、HCl,没有CO
B.一定有N2,CO和HCl中至少有一种
C.一定有N2、CO和HCl
D.一定没有N2,CO和HCl中至少有一种难度: 中等查看答案及解析
-
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )选项 W X A 盐酸 Na2CO3溶液 B Cl2 Fe C CO2 Ca(OH)2溶液 D NH3•H2O AlCl3溶液
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A.已知反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中1mol氧化剂得到11mole-
B.向NaClO溶液中通入少量SO2的离子方程式为:ClO-+SO2+H2O=Cl-+SO42-+2H+
C.已知反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,该反应中Cu2S既是氧化产物又是还原产物
D.某反应体系中的物质有:N2O、FeSO4、Fe2(SO4)3、HNO3、Fe(NO3)3、H2O,若H2O是生成物,则N2O是还原产物难度: 中等查看答案及解析
-
下列制备物质的设计中,理论上正确、操作上可行、经济上合理的是( )
A.COCO2
Na2CO3溶液
B.CuCu(NO3)2溶液
Cu(OH)2
C.FeFe2O3
Fe2(SO4)3溶液
D.CaOCa(OH)2
Naoh溶液
难度: 中等查看答案及解析
-
已知A、B、C、D的原子序数都不超过18,它们的离子aA(n+1)+、bBn+、cC(n+1)-、dDn-均具有相同的电子层结构,则下列叙述正确的是( )
A.原子序数:a>b>c>d
B.离子半径:A(n+1)+>Bn+>C(n+1)->Dn-
C.离子还原性:A(n+1)+>Bn+,离子氧化性:C(n+1)->Dn-
D.单质还原性:B>A,单质氧化性:D>C难度: 中等查看答案及解析
-
下列各组物质性质比较中,正确的是( )
A.氢化物沸点:HI>HBr>HCl>HF
B.离子半径:K+>Cl->S2-
C.分子稳定性:HF>HCl>HBr>HI
D.单质熔点:Li<Na<K<Rb难度: 中等查看答案及解析
-
硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元.硅氧四面体可以用投影图表示成
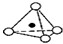 ,其中O表示氧原子,中心黑点表示硅原子.硅氧四面体通过不同方式的连接可以组成各种不同的多聚硅酸根离子.图示为某无限长单链的多聚硅酸根离子(见图),试确定该阴离子中硅原子与氧原子的个数之比为( )
,其中O表示氧原子,中心黑点表示硅原子.硅氧四面体通过不同方式的连接可以组成各种不同的多聚硅酸根离子.图示为某无限长单链的多聚硅酸根离子(见图),试确定该阴离子中硅原子与氧原子的个数之比为( )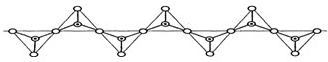
A.1:2
B.1:3
C.1:4
D.2:5难度: 中等查看答案及解析
-
将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )
A.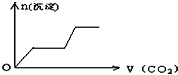
B.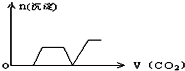
C.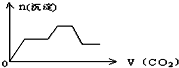
D.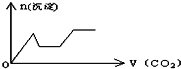
难度: 中等查看答案及解析
-
下列关系图中,A是一种正盐,D相对分子质量比C相对分子质量大16,E是酸,当X 无论是强酸还是强碱时都有如下转化关系当 X 是强酸时,A、B、C、D、E均含有同一种元素;当X是强碱时,A、B、C、D、E 均含有另一种元素.下列说法一定不正确的是( )

A.D和Z反应生成E不是氧化还原反应
B.当X是强碱时,E是HNO3
C.当X是强酸时,E是H2SO4
D.当X是强酸时,C在常温下是气态单质难度: 中等查看答案及解析
-
右图是一种形状酷似罗马两面神Janus的有机物结构简式,化学家建议将该分子叫做“Janusene”,有关Janusene的说法正确的是( )

A.Janusene的分子式为C30H22
B.Janusene属于苯的同系物
C.Janusene苯环上的一氯代物有6种
D.Janusene既可发生氧化反应,有可发生还原反应难度: 中等查看答案及解析
-
阿魏酸在食品、医药等方面有着广泛用途.一种合成阿魏酸的反应可表示为下列说法正确的是( )

A.阿魏酸与香兰素可用酸性KMnO4溶液鉴别
B.香兰素、阿魏酸均可与NaHCO3、NaOH溶液反应
C.1mol香兰素最多可与5molH2发生加成反应
D.阿魏酸与溴水既能发生加成反应又能发生取代反应难度: 中等查看答案及解析
-
用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H):m(O)>1:8.下列对导致这一结果的原因的分析中,一定错误的是( )
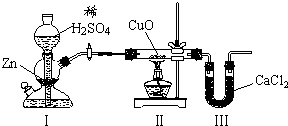
A.Ⅰ、Ⅱ装置之间缺少干燥装置
B.Ⅲ装置后缺少干燥装置
C.CuO部分被还原成Cu2O
D.Ⅱ装置中玻璃管内有水冷凝难度: 中等查看答案及解析
-
已知反应:3BrF3+5H2O=Br2+HBrO3+9HF+O2,若生成标准状况下6.72L O2,则被H2O还原的BrF3的物质的量为( )
A.0.3mol
B.0.4mol
C.0.6mol
D.0.9mol难度: 中等查看答案及解析