-
人类的日常生活、工农业生产都与化学密不可分。请回答:
(1)农业上使用的硝酸钾属于_________肥。
(2)饮用硬度过大的水不利于健康,生活中常用_________方法来降低水的硬度。
(3)冰箱中放活性炭除去异味,这是利用了活性炭的________性。
(4)有机合成材料的出现是材料史上的一次重大突破。下列属于有机合成材料的是______。
A 不锈钢汤勺 B 塑料果盘 C 纯棉围巾 D 玻璃杯
难度: 简单查看答案及解析
-
用化学用语填空。
(1)两个氢原子________;(2)地壳中含量最多金属元素的离子________;
(3)天然气的主要成分_______;(4)生活中常作食品干燥剂的氧化物________。
难度: 简单查看答案及解析
-
如图是甲、乙、丙三种固体物质的溶解度曲线。回答相关问题
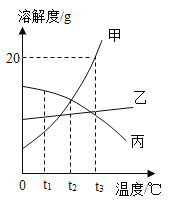
(1)t3℃时,甲物质的饱和溶液中,溶质、溶剂、溶液的质量之比为_____。
(2)t2℃时,甲、乙、丙三种物质的饱和溶液中,溶质质量分数的大小关系是_____(用“甲”、“乙”、“丙”及“>”、“<”或“=”表示)
(3)将t3℃的甲、乙、丙三种物质的饱和溶液各100g,分别降温至t1℃,所得溶液的质量最大是_____(用“甲”、“乙”、“丙”填空)。
(4)现有甲、乙混合物溶液,需要从混合物溶液中提纯乙固体,采用的方法有(写出一种即可)_____。
难度: 中等查看答案及解析
-
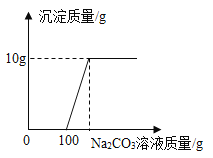
发展低碳经济,降低碳排放,就是要尽量减少温室气体二氧化碳的排放!下图是部分物质与二氧化碳的相互转化关系,请回答下列问题:
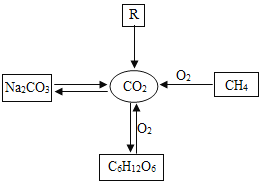
(1)碳酸钠在高温下与SiO2发生反应,化学方程式为:Na2CO3+SiO2
 Na2SiO3+ CO2↑,Na2SiO3中硅元素的化合价为______价;
Na2SiO3+ CO2↑,Na2SiO3中硅元素的化合价为______价;(2)葡萄糖在酶的催化作用下缓慢氧化可转变为二氧化碳,其原理可以表示为:C6H12O6+6O2
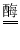 6CO2+ 6X,其中X的化学式为____;
6CO2+ 6X,其中X的化学式为____;(3)物质R能发生分解反应生成CO2,写出一个符合要求的化学方程式____;
(4)甲烷是天然气的主要成分,甲烷(CH4)、乙烷(C2H6)、丙烷、丁烷(C4H10)等物质都属于有机物中的烷烃,写出丙烷燃烧的化学方程式____。
难度: 中等查看答案及解析
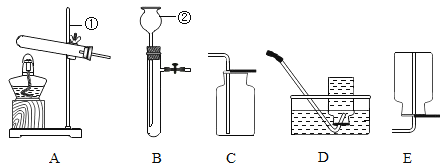
 稀释浓硫酸 B.
稀释浓硫酸 B. 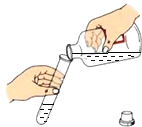 倾倒液体
倾倒液体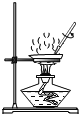 蒸发盐水 D.
蒸发盐水 D. 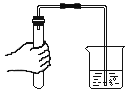 检查气密性
检查气密性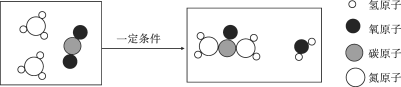
 CO(NH2)2 + H2O
CO(NH2)2 + H2O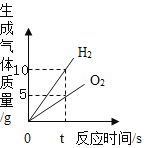 电解水
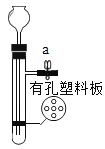
电解水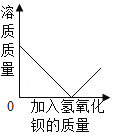 向一定量稀硫酸中不断加入氢氧化钡溶液
向一定量稀硫酸中不断加入氢氧化钡溶液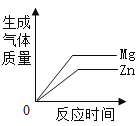 向两份等质量、相同质量分数的稀硫酸中,分别不断加入镁粉和锌粉
向两份等质量、相同质量分数的稀硫酸中,分别不断加入镁粉和锌粉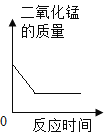 用氯酸钾和二氧化锰混合加热制取氧气
用氯酸钾和二氧化锰混合加热制取氧气