-
短周期元素X和Y组成化合物X2Y,那么X和Y所在族的序数不可能分别是
A.ⅠA和ⅦA B.ⅠA和ⅥA
C.ⅦA和ⅥA D.ⅤA和ⅥA
难度: 中等查看答案及解析
-
下列措施是为了降低化学反应速率的是
A.食品放在冰箱中贮藏 B.工业炼钢用纯氧代替空气 C.合成氨工业中使用催化剂 D.在加热条件下,用氢气还原氧化铜
难度: 中等查看答案及解析
-
下列关于元素周期表的叙述中正确的是( )
A.除0族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.除0族外,由长、短周期元素共同组成的元素族称为主族
C.主、副族元素的族序数从左到右都是由小到大排列(如ⅠB~ⅦB)
D.元素周期表共七个横行代表七个周期,18个纵列代表18个族
难度: 中等查看答案及解析
-
A、B、C三种元素的原子序数依次为a、b、c,它们的离子An+、Bn-、Cm-具有相同的电子层结构,且n > m ,则下列关系正确的是( )
A.a > b > c B.a > c > b
C.a = b + m + n D.a = c – n - m
难度: 中等查看答案及解析
-
1mol甲烷和氯气发生取代反应,待反应完成后,测得四种取代物的物质的量相等,则消耗氯气的物质的量为
A.0.5mol B.2mol C.2.5mol D.4mol
难度: 中等查看答案及解析
-
“玉兔”号月球车用
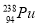 作为热源材料,下列关于
作为热源材料,下列关于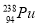 的说法正确的是( )
的说法正确的是( )A.
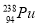 与
与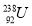 互为同位素 B.
互为同位素 B.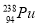 与
与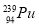 互为同素异形体
互为同素异形体C.
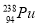 与
与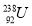 具有完全相同的化学性质 D.
具有完全相同的化学性质 D.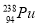 与
与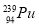 具有相同的最外层电子
具有相同的最外层电子难度: 简单查看答案及解析
-
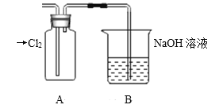
下列能说明非金属性S强于P的是
A.S的颜色比P4的颜色深 B.P4能在常温下自燃,而S不能
C.酸性:H2S<H3PO4 D.酸性:H2SO4>H3PO4
难度: 简单查看答案及解析
-
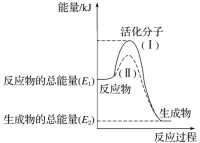
关于下图的说法不正确的是( )
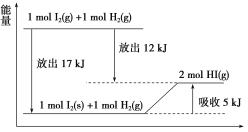
A.1 mol I2(s)与1 mol H2(g)化合生成2 mol HI(g)时,需要吸收5 kJ的能量
B.2 mol HI(g)分解生成1 mol I2(g)与1 mol H2(g)时,需要吸收12 kJ的能量
C.1 mol I2(s)变为1 mol I2(g)时需要吸收17 kJ的能量
D.I2(g)与H2(g)生成2HI(g)的反应是吸热反应
难度: 中等查看答案及解析
-
用导线把锌片与铁片连接好,然后平行插入稀硫酸中(如图所示),下列说法正确的是
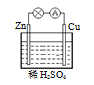
A.铜是负极 B.铜片上无气泡产生 C.锌是负极 D.铜片的质量逐渐减少
难度: 简单查看答案及解析
-
已知:X(g)+2Y(g)⇌3Z(g)放热akJ,下列说法不正确的是
A.0.1molX和0.2molY充分反应生成Z,放出能量一定小于0.1akJ
B.Y的起始浓度不能为零,平衡浓度也不能为零
C.在其他条件不变的情况下,降低反应温度,正、逆反应速率均减小
D.当反应达到平衡状态时,一定存在3v(Y)正=2v(Z)逆
难度: 简单查看答案及解析
-
将甲烷与氯气按物质的量之比为1∶3混合,在光照条件下发生化学反应后,得到的有机产物是
①CH3Cl ②CH2Cl2 ③CHCl3 ④CCl4
A.只有① B.只有③ C.①②③的混合物 D.①②③④的混合物
难度: 简单查看答案及解析
-
下表物质与其所含化学键类型、所属化合物类型完全正确的一组是( )
选项
A
B
C
D
物质
MgCl2
CO2
HCl
NaOH
化学键类型
离子键、共价键
共价键
离子键
离子键、共价键
化合物类型
离子化合物
共价化合物
离子化合物
离子化合物
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
已知汽车尾气中的NO和CO气体在一定条件下可以发生反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)。则下列说法不正确的是
A.升高温度可使该反应的逆反应速率增大
B.使用高效催化剂可有效提高正反应速率
C.反应达到平衡后,NO的反应速率保持恒定
D.单位时间内消耗CO和NO的物质的量相等时,反应达到平衡
难度: 简单查看答案及解析
-
下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
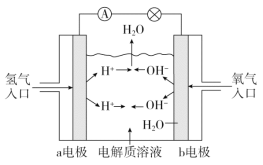
A.b电极是正极
B.总反应方程式为2H2+O2=2H2O
C.负极发生还原反应,正极发生氧化反应
D.氢氧燃料电池是一种具有广泛应用前景的绿色电源
难度: 简单查看答案及解析
-
在一个不传热的固定容积的密闭容器中,可逆反应N2(g)+3H2(g)
 2NH3(g),达到平衡的标志是
2NH3(g),达到平衡的标志是①反应速率v(N2)∶v(H2)∶v(NH3)=1∶3∶2;②各组分的物质的量浓度不再改变;③体系的压强不变;④混合气体的密度不变 (相同状况);⑤体系的温度不再发生变化;⑥2 v(N2)(正)=v(NH3)(逆) ;⑦单位时间内有3mol H—H断裂同时有2mol N—H断裂。
A.①②③⑤⑥⑦ B.②③④⑤⑥ C.②③⑤⑥ D.②③④⑥⑦
难度: 中等查看答案及解析
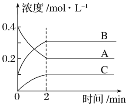
 2B(g)+C(g)
2B(g)+C(g)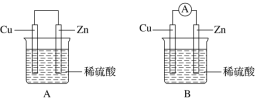
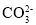 +6H2O。则下列说法正确的是______(填序号)。
+6H2O。则下列说法正确的是______(填序号)。