-
化学与生产、生活密切相关。下列事实与化学反应速率无关的是
A.食品、蔬菜贮存在冰箱或冰柜里
B.家用铁锅、铁铲等餐具保持干燥
C.制造蜂窝煤时加入生石灰
D.把块状煤碾成粉状再燃烧
难度: 简单查看答案及解析
-
下列设备工作时,将化学能转化为热能的是( )
A.
 硅太阳能电池 B.
硅太阳能电池 B. 锂离子电池
锂离子电池C.
 太阳能集热器 D.
太阳能集热器 D. 燃气灶
燃气灶难度: 简单查看答案及解析
-
“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即能制冷。该化学物质是( )
A. 酒精 B. 生石灰 C. 氢氧化钠 D. 硝酸铵
难度: 简单查看答案及解析
-
下列反应是吸热反应,但不属于氧化还原反应的是
A.铝片与稀H2SO4反应 B.Ba(OH)2·8H2O与NH4Cl反应
C.灼热的炭与CO2反应 D.甲烷在O2中的燃烧反应
难度: 简单查看答案及解析
-
已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):
H2(g)+Cl2(g)=2HCl(g) ΔH=-Q1 kJ/mol
H2(g)+Br2(g)=2HBr(g) ΔH=-Q2 kJ/mol
有关上述反应的叙述正确的是
A.Q1<Q2
B.生成物总能量均高于反应物总能量
C.生成1molHCl气体时放出Q1热量
D.1molHBr(g)具有的能量大于1molHBr(l)具有的能量
难度: 中等查看答案及解析
-
可逆反应达到化学平衡状态的重要特征是 ( )
A.反应停止了 B.正、逆反应的速率都为0
C.正、逆反应都还在进行 D.正、逆反应的速率相等且不为0
难度: 简单查看答案及解析
-
下列反应不属于可逆反应的是( )
A.Cl2溶于水 B.NH3溶于水
C.合成氨的反应 D.电解水生成H2和O2与点燃H2和O2的混合物生成水
难度: 简单查看答案及解析
-
一密闭烧瓶中装有NO2气体,在一定条件下达到化学平衡2NO2
 N2O4(正反应为放热反应)。将该烧瓶放在热水中,对现象的描述正确的是
N2O4(正反应为放热反应)。将该烧瓶放在热水中,对现象的描述正确的是A.颜色不变 B.颜色变浅 C.颜色加深 D.无法判断
难度: 简单查看答案及解析
-
在相同的温度下,已知反应:①N2(g)+O2(g)
 2NO(g)的平衡常数K=3.84×10-31;②2SO2(g)+O2(g)
2NO(g)的平衡常数K=3.84×10-31;②2SO2(g)+O2(g)  2SO3(g)的平衡常数K=3.10×1026 L·mol-1。则在该温度下,两个化学反应的反应程度之间的关系为( )
2SO3(g)的平衡常数K=3.10×1026 L·mol-1。则在该温度下,两个化学反应的反应程度之间的关系为( )A.①>② B.①<② C.①=② D.不能确定
难度: 简单查看答案及解析
-
已知:298K时,2SO2(g) + O2(g)
 2SO3(g) △H = —Q1KJ/mol,在相同温度下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q2KJ,则下列关系式正确的是( )
2SO3(g) △H = —Q1KJ/mol,在相同温度下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q2KJ,则下列关系式正确的是( )A.Q1>Q2 B.Q1<Q2 C.Q1=Q2 D.无法比较
难度: 简单查看答案及解析
-
下列说法正确的是:( )
A.其它条件不变时,升高温度,可以提高反应物的活化分子百分数
B.其它条件不变时,增大反应物的浓度,可以提高反应物的活化分子百分数
C.保持温度不变,化学平衡正向移动时,化学平衡常数增大,逆向移动时则减小
D.其它条件不变时,加入高效催化剂,可以增大化学反应速率和反应物的转化率
难度: 简单查看答案及解析
-
对于平衡体系2SO2(g)+O2(g)
 2SO3(g),增大压强时(其它条件不变)
2SO3(g),增大压强时(其它条件不变)A. SO3含量降低 B. 正反应速率加快
C. 逆反应速率减慢 D. 平衡向逆向移动
难度: 中等查看答案及解析
-
下列说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.由C(石墨,s)=C(金刚石,s) △H=+1.9kJ/mol,可知金刚石比石墨稳定
C.自发反应的熵一定增大,非自发反应的熵一定减小
D.等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
难度: 简单查看答案及解析
-
下列说法中错误的是
A.凡是放热反应而且熵增加的反应,就更易自发进行
B.对于同一物质在不同状态时的熵值是:气态>液态>固态
C.平衡常数K值越大,则可逆反应进行越完全,反应物的转化率越大
D.凡是能量达到活化能的分子发生的碰撞均为有效碰撞
难度: 简单查看答案及解析
-
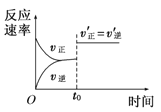
图中的曲线是表示其他条件一定时,2NO(g)+O2(g)⇌2NO2(g) ΔH<0反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v正>v逆的点是( )

A.a点
B.b点
C.c点
D.d点
难度: 中等查看答案及解析
-
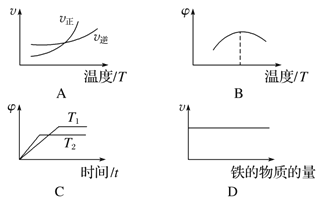
在容积不变的密闭容器中进行反应:2SO2(g)+O2(g)
 2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是A.图
 表示温度对平衡的影响,且甲温度较高
表示温度对平衡的影响,且甲温度较高B.图
 表示t0时刻恒容充入He(g)
表示t0时刻恒容充入He(g)C.图
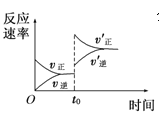 表示t0时刻增大O2的浓度对反应速率的影响
表示t0时刻增大O2的浓度对反应速率的影响D.图
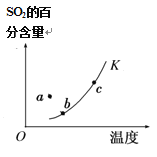 中a点v正 > v逆
中a点v正 > v逆难度: 简单查看答案及解析
-
一定温度下,反应 N2(g)+O2(g)
 2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是( )
2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是( )A.缩小体积使压强增大 B.升高体系的温度
C.恒容,充入He D.加入合适的催化剂
难度: 简单查看答案及解析
-
反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.45mol⋅L-1⋅s-1 ②v(B)=0.6mol⋅L-1⋅s-1③v(C)=0.4mol⋅L-1⋅s-1④v(D)=0.45mol⋅L-1⋅s-1,该反应进行的快慢顺序为( )
A.④<③=②<① B.④>③=②>① C.①>②>③>④ D.④>③>②>①
难度: 中等查看答案及解析
-
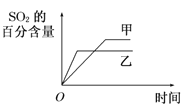
已知某反应
 在密闭容器中进行,在不同温度
在密闭容器中进行,在不同温度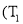 和
和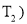 及压强
及压强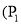 和
和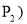 下,混合气体中
下,混合气体中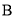 的质量分数
的质量分数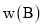 与反应时间
与反应时间 的关系如图所示,下列判断正确的是( )
的关系如图所示,下列判断正确的是( )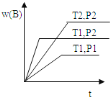
A.
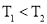 ,
,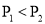 ,
,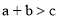 ,
,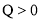
B.
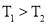 ,
,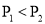 ,
,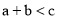 ,
,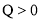
C.
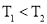 ,
,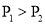 ,
,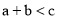 ,
,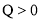
D.
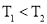 ,
,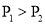 ,
,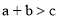 ,
,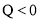
难度: 简单查看答案及解析
-
某反应的反应过程中能量变化如图所示,下列叙述不正确的是:
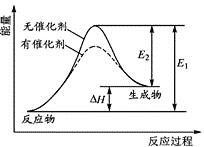
A.催化剂能改变反应的焓变 B.催化剂能降低反应所需活化能
C.该反应是吸热反应 D.逆反应的活化能小于正反应的活化能
难度: 简单查看答案及解析
-
在密闭容器中进行反应CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是( )
CO(g)+3H2(g) ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是( )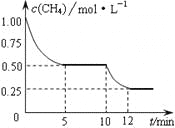
A.0~5 min内,v(H2)=0.1 mol·(L·min)-1
B.反应进行到12min时,CH4的转化率为25%
C.恒温下,缩小容器体积,平衡后H2浓度减小
D.10 min时,改变的外界条件可能是升高温度
难度: 中等查看答案及解析


 FeO(s)+CO(g) K1 ①
FeO(s)+CO(g) K1 ①