-
糖类、油脂、蛋白质是生产生活中的重要物质。下列有关说法不正确的是( )
A.淀粉在人体内水解的最终产物为葡萄糖
B.油脂属于酯类,可用于制取肥皂
C.蛋白质的基本结构单元是氨基酸
D.糖类、油脂、蛋白质中均只含有碳、氢、氧三种元素
难度: 中等查看答案及解析
-
化学与生产、生活密切相关。下列叙述错误的是
A.“煮豆燃豆箕,豆在釜中泣”,诗中涉及的能量变化主要是化学能转化为热能和光能
B.碳酸钡可用于胃肠X射线造影检查
C.明代李时珍的《本草纲目•谷四•烧酒》中记载:“……惟以糯米或粳米或黍或秫或大麦蒸熟,和麴酿瓮中七日,以甑蒸取”。该过程中涉及蒸馏操作
D.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐
难度: 中等查看答案及解析
-
硫酸锰在电解锰、染料、造纸以及陶瓷等工业生产中有广泛的应用。利用软锰矿(主要成分为MnO2,含铁的化合物等杂质)和闪锌矿(主要成分ZnS)制得硫酸锰的流程如下:
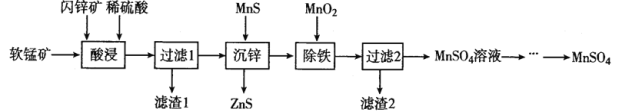
已知:常温下,Ksp(ZnS) =1.2×l0-24、Ksp(MnS)=1.5×10-15
关于该流程说法错误的是
A.“酸浸”时,为了缩短浸取时间,常加入少量FeSO4溶液,FeSO4的作用可能是作催化剂。
B.“沉锌”反应为:Zn2+(aq)+MnS(s)
 ZnS(s)+Mn2+(aq),该反应的平衡常数K为1.25×109
ZnS(s)+Mn2+(aq),该反应的平衡常数K为1.25×109C.“除铁”时加二氧化锰是为了氧化Fe2+ ,然后向溶液加适量氨水将溶液pH调节为3~4
D.该流程中可以循环利用的物质是ZnS
难度: 中等查看答案及解析
-
下列根据实验操作所得出的现象和结论均正确的是
选项
实验操作
实验现象
结论
A
向某溶液中先滴加氯水,再滴加少量KSCN溶液
溶液变成红色
原溶液中含有Fe2+
B
将变黑的银器放入装满食盐水的铝盆中,二者直接接触
银器恢复往日光泽
2Al+3Ag2S+6H2O=6Ag+2Al(OH)3+3H2S↑
C
向铬酸钾溶液中加入硫酸[已知:Cr2O72- (橙色)+H2O
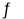 2CrO42- (黄色)+2H+]
2CrO42- (黄色)+2H+]溶液由橙色变为黄色
Cr2O72-转变为CrO42-
D
将石蜡油气化后,使气体流经碎瓷片,将生成的气体通入酸性高锰酸钾溶液
溶液紫红色褪去
碎瓷片的主要作用是使石蜡油受热均匀
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
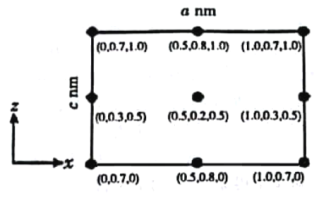
主族元素W、X、Y、Z的原子序数依次增加,且均不大于20,它们可以组成化学式为ZXY3W8的硅酸盐。X3+与W2-具有相同的电子层结构,W、Z与X、Y的质子数之和相等。下列判断正确的是
A.化合物ZXW2的水溶液呈碱性
B.简单气态氢化物稳定性:Y>W
C.最高价氧化物对应水化物酸性:X>Y
D.简单离子半径:X>Z
难度: 中等查看答案及解析
-
H3BO3(一元弱酸)可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是( )
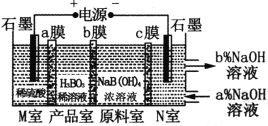
A.M室发生的电极反应式为:2H2O-4e-=O2↑+4H+
B.b膜为阴膜,产品室发生反应的化学原理为强酸制弱酸
C.理论上每生成1 mol产品,阴极室可生成标准状况下5.6 L气体
D.N室中:a%<b%
难度: 中等查看答案及解析
-
常温下,向20.00 mL 0.100 0 mol·L-1NH4Cl溶液中逐滴加入0.100 0 mol·L-1KOH溶液时,溶液的pH与KOH溶液体积的关系如图所示(不考虑挥发)。下列说法正确的是( )
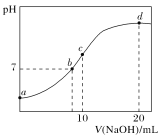
A.点a所示溶液中水的电离程度小于相同温度下纯水的电离程度
B.点b所示溶液中:c(NH4+)=c(K+)=c(H+)=c(OH-)
C.点d所示溶液中的溶质为一水合氨
D.点c所示溶液中:c(K+)+c(H+)=c(NH3·H2O)+c(OH-)
难度: 中等查看答案及解析

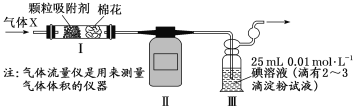
 )=1.0×10-3mol/L,则c(SO
)=1.0×10-3mol/L,则c(SO )=______________________。
)=______________________。
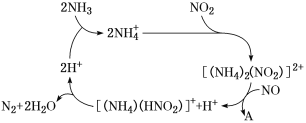
 HCN(g)+3H2(g) ΔH>0。
HCN(g)+3H2(g) ΔH>0。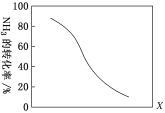
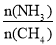
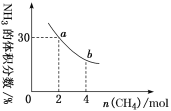
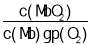 。在37 ℃条件下达到平衡时,测得肌红蛋白的结合度(α)与p(O2)的关系如图所示。[α=
。在37 ℃条件下达到平衡时,测得肌红蛋白的结合度(α)与p(O2)的关系如图所示。[α=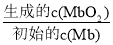 ×100%]。研究表明正反应速率v正=k正·c(Mb)·p(O2),逆反应速率v逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。试求出图中c点时,上述反应的平衡常数K=________。已知k逆=60 s-1,则速率常数k正=________s-1。
×100%]。研究表明正反应速率v正=k正·c(Mb)·p(O2),逆反应速率v逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。试求出图中c点时,上述反应的平衡常数K=________。已知k逆=60 s-1,则速率常数k正=________s-1。


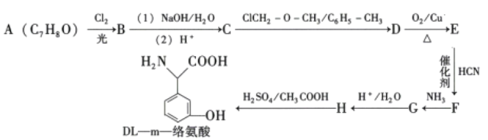

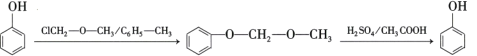
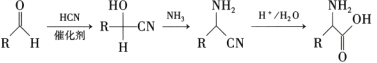
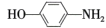 是合成药物扑热息疼的中间体。设计由苯酚和ClCH2—O—CH3制备
是合成药物扑热息疼的中间体。设计由苯酚和ClCH2—O—CH3制备