-
下列各项与反应热的大小无关的是:
A.反应物和生成物的状态 B.反应物量的多少
C.反应物的性质 D.反应的快慢
难度: 简单查看答案及解析
-
下列物质属于弱电解质的是
A.H3PO4 B.HCl C.BaSO4 D.CO2
难度: 简单查看答案及解析
-
下列微粒不能破坏水的电离平衡的是
A.S2- B.F- C.Na+ D.Fe2+
难度: 简单查看答案及解析
-
反应4A(g)+3B(g)
2C(g)+2D(g)在四种不同情况下的反应速率最快的是
A.v(A)=0.45mol·L-1·s-1 B.v(B)=0.6mol·L-1·s-1 C.v(C)=0.4mol·L-1·s-1 D.v(D)= 0.45mol·L-1·s-1
难度: 简单查看答案及解析
-
下列有利于反应自发进行的是( )
①反应吸热 ②反应放热 ③反应后熵增加 ④反应后熵减小
A.①③ B.②③ C.②④ D.①④
难度: 简单查看答案及解析
-
已知H-H键的键能为436kJ· mol-1,H-N键的键能为391 kJ· mol-1,根据热化学方程式:N2(g)+3H2(g)
2NH3(g) △H=-92.4 kJ· mol-1,可知N≡N键的键能是
A.431 kJ· mol-1 B.649 kJ· mol-1 C.945.6 kJ· mol-1 D.896 kJ· mol-1
难度: 简单查看答案及解析
-
下列关于化学平衡常数的说法中,正确的是
A.可以用化学平衡常数来定量描述化学反应的限度
B.在平衡常数表达式中,反应物浓度用起始浓度表示,生产物浓度用平衡浓度表示
C.平衡常数的大小与浓度、压强、催化剂有关
D.化学平衡发生移动,平衡常数必定发生变化
难度: 简单查看答案及解析
-
下图是中和热测定实验的装置,下列说法不正确的是
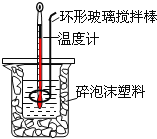
A.使用环形玻璃棒既可以搅拌又避免损坏温度计
B.测了酸后的温度计要用水清洗后再测碱的温度
C.向盛装酸的烧杯中加碱时要小心缓慢以免洒出
D.改变酸碱的用量.所求中和热数值不变
难度: 简单查看答案及解析
-
25℃时,将0.1mol·L-1氨水溶液加水稀释,下列数值变大的是
A.c(OH-) B.pH C.Kb D.n(H+)·n(OH-)
难度: 简单查看答案及解析
-
在密闭容器中,一定条件下进行如下反应2NO(g)+2CO(g)
N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
难度: 中等查看答案及解析
-
有a、b、c、d四个金属电极,G为电流计。有关的反应装置及部分反应现象如下:
实验装置
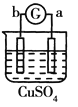
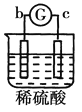
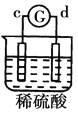
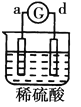
部分实验现象
a极质量减小、b极质量增加
溶液中的SO42-向b极移动
d极溶解c极有气体产生
电子从d极流向a极
由此可判断这四种金属的活动性顺序是
A. d>a>b>c B. a>b>c>d C. b>c>d>a D. a>b>d>c
难度: 简单查看答案及解析
-
下列措施中,不符合生产实际的是
A.电解法精炼粗铜,用纯铜作阴扱
B.利用外加电流的阴极保护法,可以将水下的钢闸门与电源正极相连
C.为保护地下管道中的金属铁,可将其与锌极相连
D.在镀件上电镀锌,用锌作阳极
难度: 简单查看答案及解析
-
常温下,pH=8与PH=10的NaOH溶液按体枳比1:100混合后,溶液中c( H+) 接近
A.10-10 B.10-9 C.2
l0-10 D.2
10-9
难度: 中等查看答案及解析
-
缠有金属丝的铁钉插在含有酚酞的NaCl溶液中.如图所示,可以看到在貼近金属丝的一边的溶液中出现粉红色。则该金属丝可能是
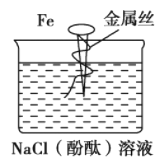
A.镁 B.铝 C.锌 D.铜
难度: 简单查看答案及解析
-
在2 L的密闭容器中充入2 molX(g)和1 mol Y(g),发生反应2X(g) +Y(g)
3Z(g) △H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,下列推断正确的是

A.升高温度.平衡常数增大
B.W点Y的正反应速率等于M点Y的正反应速率
C.Q点时,Y的转化率最大
D.平衡时充入3molZ,达到新平衡时Z的体积分数比原平衡时大
难度: 中等查看答案及解析
-
下列溶液中微粒浓度关系一定正确的是
A.氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+)
B.0.1 mol ·L-1的硫酸铵溶液中:c(NH4+)> c(SO42-)> c(H+)> c(OH-)
C.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)= c(H+)
D.0.1 mol ·L-1的硫化钠溶液中:c(OH-)=c(H+) +c(HS-)+c(H2S)
难度: 中等查看答案及解析

 图2
图2 

 B.
B. 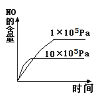 C.
C.  D.
D. 
 B.
B.  D.
D.