-
NA是阿伏加德罗常数的值。下列说法正确的是
A.10 L pH=1的H2SO4 溶液中含H+离子数为2NA
B.28 g乙烯与丙烯混合物中含有C-H键数目为4NA
C.3 mol H2与1 mol N2混合反应生成NH3,转移电子数为6NA
D.11.2 L(标准状况)Cl2 溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
难度: 中等查看答案及解析
-
气体分子中的极性键在红外线的照射下,易像弹簧一样做伸缩和弯曲运动,从而产生热量造成温室效应。下列不属于温室效应气体的是
A. CO2 B. N2O C. CH4 D. N2
难度: 简单查看答案及解析
-
支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,下列有关表述错误的是
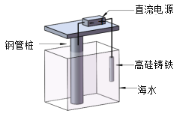
A.利用了电解原理
B.钢管桩上有刺激性气味气体生成
C.电子由电源负极流向钢管桩
D.高硅铸铁作阳极
难度: 中等查看答案及解析
-
位于不同主族的四种短周期元素甲、乙、丙、丁,其原子序数依次增大,原子半径r(丁)>r(乙)>r(丙)>r(甲)。四种元素中,只有一种为金属元素,乙和丙原子的最外层电子数之和为丁原子的最外层电子数的3倍。据此推断,下述正确的是
A.简单氢化物的沸点:乙>丙
B.由甲、乙两元素组成的化合物溶于水呈碱性
C.丙和丁两元素的最高价氧化物的水化物之间能发生反应
D.由甲和丙两元素组成的分子,不可能含非极性键
难度: 中等查看答案及解析
-
电解合成 1 , 2-二氯乙烷的实验装置如图所示。下列说法中正确的是
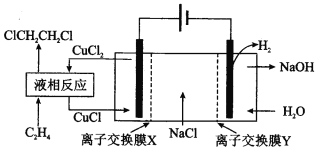
A. 该装置工作时,化学能转变为电能
B. CuCl2能将C2H4还原为 l , 2-二氯乙烷
C. X、Y依次为阳离子交换膜、阴离子交换膜
D. 该装置总反应为CH2CH2 + 2H2O + 2NaCl
H2 + 2NaOH + ClCH2CH2Cl
难度: 中等查看答案及解析
-
25℃时,改变0.1mol·L-1H2SO3溶液的pH,各微粒的物质的量分数(α)变化如图所示,下列说法中错误的是
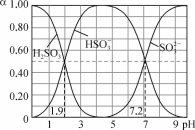
A. 1gK1(H2SO3)=-1.9
B. pH=3时,c(HSO3-)>c(H2SO3)>c(SO32-)
C. 反应H2SO3+SO32-
2HSO3-的lgK=5.3
D. pH=7.2时,c(HSO3-)=c(SO32-)=c(H+)
难度: 中等查看答案及解析


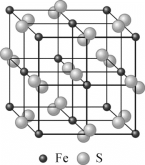
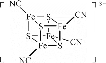 中,S、C、N的化合价依次为-2、+2、-3,Fe2+与Fe3+数目之比为________;与铁形成配位键的原子是________。
中,S、C、N的化合价依次为-2、+2、-3,Fe2+与Fe3+数目之比为________;与铁形成配位键的原子是________。