-
下列说法中错误的是( )
A. 0.1 mol/L的HCl与0.1 mol/L的NH3·H2O等体积混合,溶液中的c(NH4+)>c(Cl-)
B. 常温下pH=3的HCl与pH=11的氨水等体积混合,溶液中的c(OH-)>c(H+)
C. pH=11的NaCN溶液中,由水电离出来的c(OH-)=c(H+)
D. CO2、SO2的水溶液能导电,但它们是非电解质
难度: 中等查看答案及解析
-
某物质溶于水能导电,且该物质属于非电解质,则该物质是( )
A.液溴 B.干冰 C.蔗糖 D.硫酸钡
难度: 中等查看答案及解析
-
某化学反应其△H=" -122" kJ·mol-1,∆S=" -431" J·mol-1·K-1,则以下关于此反应的自发性描述中正确的是( )
A.在任何温度下都能自发进行 B.仅在低温下自发进行
C.仅在高温下自发进行 D.在任何温度下都不能自发进行
难度: 简单查看答案及解析
-
已知:C(s)+ H2O(g)== CO(g) + H2(g) △H = a kJ·mol-1
2 C(s)+ O2(g)== 2CO(g) △H = -220 kJ·mol-1
H-H 、O=O和O-H键的键能(kJ·mol-1)分别为436、496和462,则a为( )
A.-332 B.-118 C.+350 D.+130
难度: 中等查看答案及解析
-
把0.6 mol X气体和0.4 mol Y气体混合于2 L容器中,使它们发生如下反应:3X(g)+Y(g)
nZ(g)+2W(g),在5 min时已经生成0.2 mol W,若测知以Z的浓度变化表示平均反应速率为0.01 mol·L-1·min-1,则上述反应中Z气体的化学计量数n的值是( )
A.1 B.2 C.3 D.4
难度: 中等查看答案及解析
-
下列关于原电池和电解池的叙述正确的是( )
A.原电池中失去电子的电极为正极
B.电解时电解池的阳极一定是阴离子放电
C.原电池的两极一定是由活动性不同的两种金属组成的
D.原电池的负极、电解池的阳极都发生氧化反应
难度: 简单查看答案及解析
-
反应X(g)+Y(g)
2Z(g) ΔH<0,达到平衡时,下列说法正确的是( )
A. 减小容器体积,平衡向右移动
B. 加入催化剂,Z的产率增大
C. 增大c(X),X的转化率增大
D. 降低温度,Y的转化率增大
难度: 简单查看答案及解析
-
下列有关反应速率的说法中正确的是( )
A.等质量的锌粉和锌片与相同体积、相同浓度的盐酸反应,反应速率相等
B.氢气与氮气能够缓慢反应生成氨,使用合适催化剂可以提高反应速率
C.用铁片与硫酸制备氢气时,浓硫酸可以加快产生氢气的速率
D.二氧化硫催化氧化反应的ΔH<0,所以升高温度,反应速率减小
难度: 中等查看答案及解析
-
T ℃时,在0.5 L的密闭容器中,气体A与气体B反应生成气体C,反应过程中A、B、C的浓度变化如图所示。则下列结论正确的是
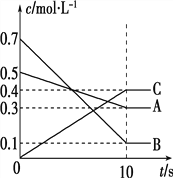
A. 10 s时反应生成了0.2 mol C
B. 该反应进行到10 s时,消耗了0.2 molA
C. 该反应的化学方程式为3A+B
2C
D. 10 s内用B表示的反应速率为0.01 mol·L-1·s-1
难度: 中等查看答案及解析
-
下列关于平衡常数K的说法中,正确的是
①平衡常数K只与反应本身及温度有关
②改变反应物浓度或生成物浓度都会改变平衡常数K
③加入催化剂不改变平衡常数K
④平衡常数K只与温度有关,与反应的本身及浓度、压强无关
A.①② B.②③ C.③④ D.①③
难度: 中等查看答案及解析
-
下列与化学反应的能量变化有关的叙述正确的是( )
A.有热量变化的过程一定是化学反应
B.一个反应的反应物的总能量可能等于其生成物的总能量
C.强酸与强碱的中和反应的热化学方程式均可表示为H+(aq)+OH-(aq)=H2O(l)
ΔH =-57.3 kJ·mol-1
D.由石墨比金刚石稳定可知,C(金刚石)=C(石墨) ΔH<0
难度: 中等查看答案及解析
-
在一定温度下,向蒸馏水中滴入少量盐酸后,下列说法中错误的是( )
A.c(H+)和c(OH-)的乘积不变 B.促进了水的电离
C.c(OH-)降低了 D.水电离出的c(H+)降低了
难度: 中等查看答案及解析
-
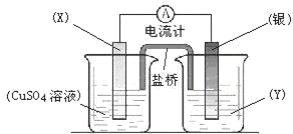
下列关于图所示装置的叙述正确的是( )
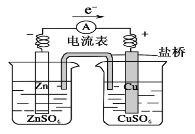
A.铜离子在铜片表面被氧化
B.铜片质量逐渐减少
C.铜作正极,铜片上有气泡产生
D.盐桥中阳离子流向右烧杯,阴离子流向左烧杯
难度: 简单查看答案及解析
-
下列金属的防护方法不正确的是 ( )
A.对健身器材涂油漆以防止生锈
B.用牺牲锌块的方法来保护船体
C.对某些工具的“机械转动部位”选用刷油漆的方法来防锈
D.在地下输油的铸铁管上接直流电源的负极来防锈
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理(平衡移动原理)解释的是
①溴水中存在化学平衡:Br2+H2O
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
②铁在潮湿的空气中易生锈
③二氧化氮与四氧化二氮的平衡体系,增大压强后颜色加深
④合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
⑤钠与氯化钾共融制备钾:Na(l)+KCl(l)
K(g)+NaCl(l)
⑥反应CO(g)+NO2(g)
CO2(g)+NO(g)(正反应为放热反应),达到化学平衡后,升高温度体系的颜色加深
A.①④ B.②③ C.②⑥ D.②③⑥
难度: 中等查看答案及解析
-
用石墨作电极,电解1 mol/L下列物质的溶液,溶液的pH保持不变的是( )
A.Na2SO4 B.NaOH C.HCl D.NaCl
难度: 简单查看答案及解析
-
下列有关热化学方程式及其叙述正确的是( )
A.氢气的燃烧热为285.5 kJ•mol-1,则水电解的热化学方程式为:2H2O(l)
2H2(g)+O2(g)
H=+285.8kJ•mol-1
B.1mol甲烷完全燃烧生成CO2 (g)和H2O(l)时放出890kJ热量,它的热化学方程式为 1/2CH4(g)+O2(g)
1/2CO2(g)+H2O(l)
H=-445kJ•mol-1
C.已知2C(s)+O2(g)
2CO(g)
H=-221kJ•mol-1,则C的燃烧热为110.5 kJ•mol-1
D.HF与NaOH溶液反应:H+(aq)+OH-(aq) = H2O(l)
H=-57.3kJ•mol-1
难度: 中等查看答案及解析
-
在温度和其他条件不变的情况下,向AgCl饱和溶液中加水,下列叙述正确的是( )
A.AgCl的溶解度增大 B.AgCl的溶解度、Ksp均增大
C.AgCl的溶解度、Ksp均不变 D.AgCl的Ksp增大
难度: 中等查看答案及解析
-
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.在碱性介质中,氢氧燃料电池的负极反应式:O2+2H2O+4e-= 4OH-
B.钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-= Cu2+
D.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-= Cl2↑
难度: 中等查看答案及解析
-
常温下,下列能大量共存的离子组为( )
A.pH=8的溶液中:Fe3+、Cl-、Na+、NO3-
B.pH=1的溶液中:NH4+、Cl-、Mg2+、SO42-
C.Al3+、HCO3-、I-、Ca2+
D.由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、CO32-、Cl-、K+
难度: 中等查看答案及解析
-
25 ℃时,某溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-18,则下列说法正确的是( )
A.该溶液的pH一定是9 B.该溶液的pH可能为5
C.该溶液的pH可能是7 D.不会有这样的溶液
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.常温下,AgCl在等物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
B.常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4)
C.向AgCl浊液中滴加Na2S溶液,白色沉淀变成黑色,说明AgCl的溶解平衡正向移动
D.已知Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgCl)=1.8×10-10,说明Ag2CrO4的溶解度小于AgCl
难度: 中等查看答案及解析