-
下列说法错误的是( )
A.建筑钢筋属于金属材料
B.制玻璃和水泥都要用到石灰石
C.天然气、水煤气、液化石油气均是化合物
D.聚乙烯、纤维素都属于高分子化合物
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确是( )
A.12g金刚石中含有共价键数目为4NA
B.标况下2.24L SO3含有的氧原子数目为0.3 NA
C.1L 0.1mol·L-1NH4NO3溶液中含有氮原子总数为0.2NA
D.电解熔融氯化钠,当阳极生成2.24L氯气时,阴极产生0.1NA个Na
难度: 中等查看答案及解析
-
下图为N2分子在催化剂的作用下发生的一系列转化示意图:
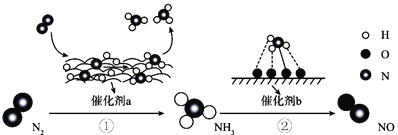
下列叙述错误的是( )
A.反应①属于氮的固定;反应②可用于合成HNO3
B.在催化剂a、b的作用下,提高了反应速率
C.在反应①和反应②中,均有极性共价键形成
D.在催化剂b作用下,氮原子发生了还原反应
难度: 中等查看答案及解析
-
已知苯乙烯和立方烷的结构分别为
(b)、
(p)。下列说法中正确的是( )
A.b、p难溶于苯
B.b、p互为同分异构体
C.b、p的一氯代物分别有6种和1种(不考虑立体异构)
D.b、p均不能使酸性KMnO4溶液褪色
难度: 困难查看答案及解析
-
含有对氯苯酚和醋酸钠的废水净化原理如图所示。下列说法错误的是( )
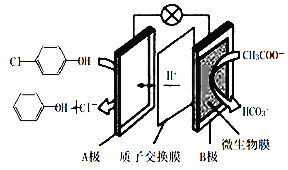
A.本装置集净化、供电于一体,产物之一还有消毒作用
B.每消耗1mol CH3COO-,通过质子交换膜的质子的物质的量为8mol
C.在该装置中,B极上的电势比A极上的电势高
D.A极的电极反应为
+H++2e-→
+Cl-
难度: 困难查看答案及解析
-
五种短周期主族元素的关系如图所示。TX2是制光导纤维制品的主要原料。下列说法中错误的是( )
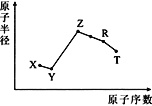
A.Y是非金属性最强的元素
B.R与X形成的化合物是一种两性化合物
C.T的晶体是一种重要的半导体材料
D.简单离子半径Y比Z、R的都小
难度: 中等查看答案及解析
-
25℃时,进行下图所示滴定并得到对应曲线。下列说法错误的是( )
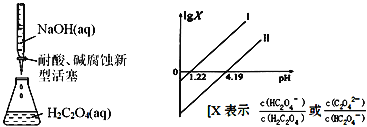
A.Ka2(H2C2O4)=10-4.19
B.直线Ⅰ中X=
C.在NaHC2O4溶液中c(H2C2O4)+c(H+)=c(OH-)+c(C2O42-)
D.Ⅰ、Ⅱ两条直线的斜率均为1
难度: 困难查看答案及解析

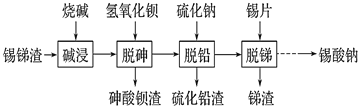
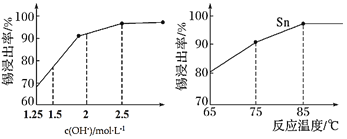
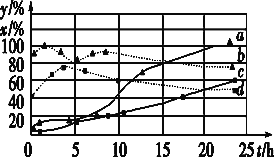
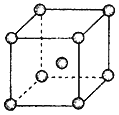
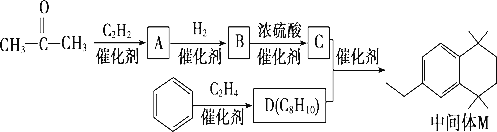
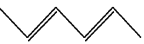 的合成路线(用流程图表示,无机试剂任选):_________________________。
的合成路线(用流程图表示,无机试剂任选):_________________________。