-
短周期主族元素W、X、Y、Z的原子序数依次增大,W的最低负价等于X、Z的最低负价之和,Y的周期数是族序数的3倍,W的简单氢化物与X的简单氢化物化合形成的盐中既含离子键又含共价键。下列说法正确的是( )
A. 常压下,单质的沸点:W>Z
B. Y与X形成化合物的水溶液呈碱性
C. 原子半径:W<X<Y<Z
D. W的氧化物的水化物的酸性比Z的弱
难度: 中等查看答案及解析
-
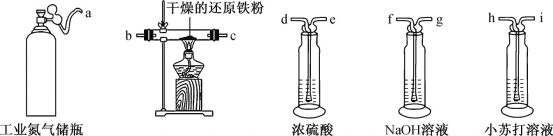
近日,北京某区食药监局向居民发放了家用食品快检试剂盒.试剂盒涉及的部分检验方法如下,其中不是通过化学原理进行检验的是( )
A.通过测定大米浸泡液的pH检验大米新鲜度
B.用含Fe2+的检测试剂检验自来水中余氯的含量
C.向食盐样品中加还原剂和淀粉检测食盐的含碘量
D.通过观察放入检测液中鸡蛋的沉浮检验鸡蛋新鲜度
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是( )
A.
标准状况
和
的混合气体中含电子总数为
B.
氢化钾
与足量水反应转移电子数为
C.92g甘油
丙三醇
中含C一H键总数为
D.
溶液中
和
数之和为
难度: 中等查看答案及解析
-
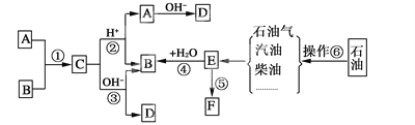
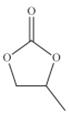
化合物
 的分子式均为C5H8O2,下列说法正确的是( )
的分子式均为C5H8O2,下列说法正确的是( )A.x分子中碳原子均位于同一平面
B.x、y均能与NaOH溶液发生反应
C.y、z均能与
反应生成
D.与它们互为同分异构体的链状羧酸有6种
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.氯气溶于水:Cl2+H2O⇌2H++Cl﹣+ClO﹣
B.向FeSO4溶液中加入H2SO4酸化的KMnO4溶液:5Fe2++MnO4﹣+8H+═5Fe3++Mn2++4H2O
C.向少量澄清石灰水中加入足量的NaHCO3溶液:Ca2++OH﹣+HCO3﹣═CaCO3↓+H2O
D.用铜做电极电解NaCl溶液:2Cl﹣+2H2O
H2↑+Cl2↑+2OH﹣
难度: 中等查看答案及解析
-
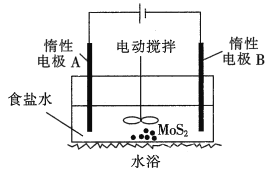
一种三室微生物燃料电池污水净化系统原理如图所示,图中含酚废水中有机物可用C6H6O表示,左、中、右室间分别以离子交换膜分隔。下列说法不正确的是( )
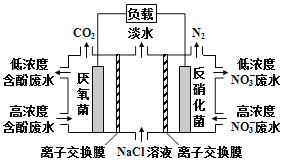
A.左池的pH值降低
B.右边为阴离子交换膜
C.右池电极的反应式:2NO3-+10e-+12H+=N2↑=6H2O
D.当消耗0.1mol C6H6O,在标准状况下将产生0.28mol氮气
难度: 困难查看答案及解析
-
25℃时,向0.10mol·L-1的H2C2O4(二元弱酸)溶液中滴加NaOH溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法不正确的是
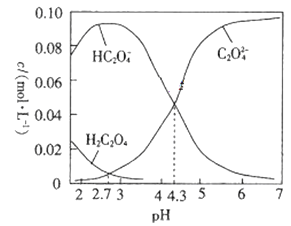
A. 25℃时H2C2O4的一级电离常数为Ka1=10‑4.3
B. pH=2.7的溶液中:c(H2C2O4)=c(C2O42-)
C. pH=7的溶液中:c(Na+)>2c(C2O42-)
D. 滴加NaOH溶液的过程中始终存在:c(OH-)+2c(C2O42-)+c(HC2O4-)=c(Na+)+c(H+)
难度: 中等查看答案及解析