-
朱自清在《荷塘月色》冲写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的班驳的黑影……”月光穿过薄雾形成的种种美景本质原因是
A. 空气中的小水滴颗粒直径大小约为1nm--100nm
B. 空气中的小水滴颗粒的布朗运动
C. 雾是一种胶体,胶粒带相同电荷
D. 发生丁达尔效应
难度: 简单查看答案及解析
-
化工厂常用浓氨水检验管道是否漏氯气,其反应为:3 Cl2 + 8 NH3 ═ 6 NH4Cl +N2当有160.5 g NH4Cl产生时,被氧化的氨是
A. 214 g B. 53.5 g C. 17 g D. 68 g
难度: 中等查看答案及解析
-
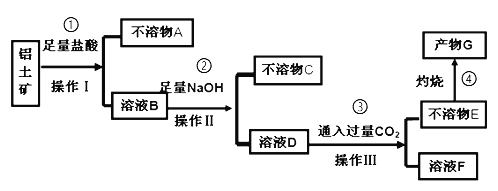
中国传统文化对人类文明贡献巨大,古代文献中充分记载了古代化学研究成果,我国晋代《抱朴子》中描述了大量的化学反应,其中有①“丹砂烧之成水银,积变又成丹砂”;②“以曾青涂铁,铁赤色如铜”,下列有关叙述正确的是( )(已知丹砂化学式为HgS)
A.①中水银“积变又成丹砂”说明水银发生了还原反应
B.②中反应的离子方程式为2Fe+3Cu2+=2Fe3++3Cu
C.根据①可知温度计打破后可以用硫粉覆盖水银,防止中毒
D.水银能跟曾青发生置换反应生成单质铜
难度: 中等查看答案及解析
-
下列实验中,所选装置不合理的是( )
A.
 除去CO中的CO2
除去CO中的CO2B.
 分离乙醇和水
分离乙醇和水C.
 除去水中泥沙
除去水中泥沙D.
 收集氯气
收集氯气难度: 简单查看答案及解析
-
对于相同温度、相同压强下,相同物质的量的SO2和SO3,下列说法中正确的是( )
A.硫元素的质量比为5:4 B.质量之比为1:1
C.分子数之比为5:4 D.密度之比为4:5
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.0.1mol Fe与足量氯气反应时,转移的电子数目为0.2NA
B.常温常压下,18 g H2O中含有的原子总数为3NA
C.标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA
D.1 L 0.1 mol·L-1硫酸钠溶液中含有的氧原子数为0.4NA
难度: 中等查看答案及解析
-
除去下列括号内杂质能达到目的的是( )
A.NaCl溶液(K2SO4):BaCl2溶液 B.CO 2气体(SO2):NaOH溶液
C.Fe2(SO4)3溶液(FeSO4):氯水 D.MgO固体(Al2O3):NaOH溶液
难度: 中等查看答案及解析
-
在下列条件的溶液中,各组离子一定能够大量共存的是( )
A.使酚酞溶液变红的溶液:Na+、Cl-、SO42-、Fe3+
B.无色透明溶液中:K+、SO42-、MnO4-、H+
C.含有大量OH-的溶液中:Ba2+、Na+、NO3-、Cl-
D.可与锌反应放出氢气的溶液中:Na+、Ca2+、Cl-、CO32-
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示物质间转化均能实现的是( )
A.CaCO3
CaO
CaSiO3
B.Fe
FeCl2
Fe(OH)3
C.Al
H2
Cu
D.S
SO3
H2SO4
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.Ba(OH)2和H2SO4两溶液混合:Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.氯气溶于水:H2O+Cl2= 2H++ Cl-+ClO-
C.锌和硝酸银溶液反应:Zn+Ag+=Ag+Zn2+
D.向Al2(SO4)3溶液中加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
难度: 中等查看答案及解析
-
下列各组中的两种物质反应时,反应条件或反应物用量或浓度的改变,对生成物没有影响的是( )
A.Na和O2 B.Cl2和H2
C.Ca(OH)2溶液和CO2 D.Cu和HNO3溶液
难度: 中等查看答案及解析
-
下列有关硫及其化合物的说法中正确的是( )
A.浓硫酸与灼热的炭反应,体现了浓硫酸的强氧化性和酸性
B.浓硫酸具有吸水性,可做干燥剂,不能干燥 NH3、 H2S等气体
C.SO2 和 Cl2 均可使品红溶液褪色,但将溶有 SO2 的品红溶液加热后又恢复红色,说明 SO2 的氧化性没有 Cl2 强
D.以 FeS和稀硫酸反应制H2S气体为氧化还原反应
难度: 中等查看答案及解析
-
下列实验结论与实验操作及现象相符的一组是( )
选项
实验操作及现象
实验结论
A.
向某溶液中加入HCl 溶液,产生的气体使澄清的石灰水变浑浊
该溶液中含有CO32-
B.
向某溶液中通入Cl2,再加入KSCN溶液,溶液变红
该溶液中一定含有Fe2+
C.
铁粉加入CuSO4溶液中,析出红色固体
氧化性:Fe2+ > Cu2+
D.
向FeCl3溶液中滴加浓的维生素C溶液,黄色褪去
维生素C具有还原性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
如图是病人输液用的葡萄糖(分子式为C6H12O6)注射液的标签上的部分内容。据标签所提供的信息,以下说法错误的是( )
5%葡萄糖注射液
500 mL
(性状)本品为无色或几乎为无色的透明液体
(规格)500 mL 25 g
(贮藏)密封保存
A. 该注射液中葡萄糖的质量分数是5%
B. 葡萄糖的摩尔质量为180 g·mol-1
C. 该注射液的密度约为1g·cm-3
D. 该注射液中葡萄糖的物质的量浓度约为0.014mol·L-1
难度: 中等查看答案及解析
-
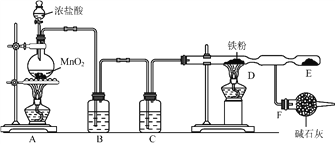
仅用下图装置可完成(装置可加热):
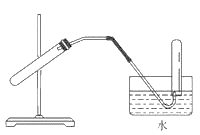
A.用锌粒与稀H2SO4反应制H2
B.用 NH4CI 与 Ca(OH)反应制 NH3
C.用Cu与浓HNO3反应制NO2
D.浓硫酸和铜制SO2
难度: 简单查看答案及解析
-
把Na2CO3和NaHCO3的混合物27.4g加热到质量不再变化时,得残留固体21.2g。求原混合物中NaHCO3和Na2CO3的质量之比为( )
A.53∶84 B.1∶1 C.84∶53 D.42∶53
难度: 中等查看答案及解析