-
化学在生产和日常生活中有着重要的应用,下列说法正确的是( )
A.泡沫灭火器可用于一般的起火,也适用于电器起火
B.太阳能电极板的主要材料是高纯度的硅单质
C.碳酸钡可用于胃肠X射线造影检查
D.医用消毒酒精中乙醇的浓度为95%
难度: 简单查看答案及解析
-
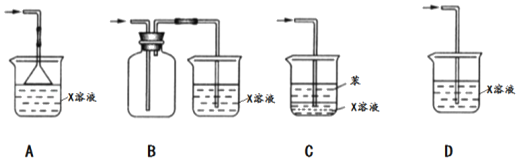
下列相关实验装置及操作能达到实验目的是( )
A.
 分离MnO2和KCl
分离MnO2和KClB.
 “海带提碘”实验中灼烧海带
“海带提碘”实验中灼烧海带C.
 用乙醇萃取碘水中的碘
用乙醇萃取碘水中的碘D.
 除去自来水中含有的杂质制取蒸馏水
除去自来水中含有的杂质制取蒸馏水难度: 简单查看答案及解析
-
电解质溶于水后电离出的阴阳离子是能够导电的,而且溶液的导电能力与溶液中离子所带电荷的浓度有关。下列溶液的导电能力最强的是( )
A.0.1 mol/L CaCl2溶液
B.0.2 mol/L NaCl溶液
C.0.3 mol/L CuSO4溶液
D.0.4 mol/L HNO3溶液
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列判断正确的是( )
A.标准状况下,5.6 L四氯化碳含有分子数为0.25NA
B.常温常压下,1 mol氦气含有的核外电子数为4NA
C.5.6 g铁粉与一定量稀硝酸恰好完全反应,反应中转移电子数一定为0.3NA
D.46 g NO2和N2O4混合气体含有原子数一定为3NA
难度: 中等查看答案及解析
-
下列各组离子,在指定的环境中一定能大量共存的是( )
A.某无色酸性溶液中:NH4+、Ca2+、F﹣、Cl﹣
B.与金属铝反应只放出氢气的溶液:K+、NH4+、NO3﹣、Cl﹣
C.能使淀粉碘化钾试纸变蓝的溶液中:Na+、NH4+、S2﹣、Br﹣
D.滴加酚酞试液变红色的溶液:K+、Na+、S2﹣、Cl﹣
难度: 中等查看答案及解析
-
下列离子方程式中,正确的是( )
A.氨气通入醋酸溶液:CH3COOH+NH3 ═CH3COO﹣+NH4+
B.碳酸氢钠溶液中加过量石灰水:2HCO3﹣+Ca2++2OH﹣═CaCO3↓+2H2O+CO32﹣
C.澄清石灰水与稀盐酸反应:Ca(OH)2 +2H+═Ca2++2H2O
D.稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑
难度: 中等查看答案及解析
-
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的反应如下:4FeO42﹣+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH﹣下列有关说法中正确的是( )
A.高铁酸钾与水反应时,水发生还原反应
B.K2FeO4处理水时,不仅能消毒杀菌,而且使悬浮杂质沉降达到净水效果
C.上述反应每生成5.6 L O2共转移NA个电子
D.每消耗1 mol K2FeO4可以生成1 mol Fe(OH)3胶粒
难度: 中等查看答案及解析
-
下列有关钠及其化合物的有关说法中正确的是( )
A.钠与CuSO4溶液反应的离子方程式为2Na+Cu2+═Cu+2Na+
B.7.8 g Na2O2含离子数为0.4NA
C.“侯氏制碱法”中的碱指NaHCO3
D.向Na2CO3饱和溶液中通入足量的CO2,有NaHCO3结晶析出
难度: 中等查看答案及解析
-
下列实验的现象、解释或结论均正确的是( )
选项
实验操作及现象
解释或结论
A
向某溶液中加入BaCl2溶液,有白色沉淀产生,再加盐酸,沉淀不消失
原溶液一定含有SO42﹣
B
用某无色溶液进行焰色反应,火焰呈黄色
原溶液一定是钠盐溶液
C
向某溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝
原溶液一定有NH4+
D
向某溶液中加入CCl4,CCl4层显紫色
原溶液一定有I﹣
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
铁是人类应用较早,当前应用量最大的金属元素。下列有关说法中正确的是( )
A.人类使用铁制品在铝之后
B.常温下,铁不能与浓硝酸反应
C.铁与水蒸气在高温下的反应产物为Fe2O3和H2
D.除去FeCl3溶液中的FeCl2杂质可以向溶液中加入适量氯水
难度: 简单查看答案及解析
-
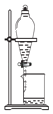
为确定HCl、H2CO3、H2SiO3的酸性强弱,某同学设计了如图所示的装置,下列有关叙述正确的是( )

A.HCl、H2CO3、H2SiO3的酸性依次增强
B.A中锥形瓶中生成CO2气体
C.B中装饱和Na2CO3溶液,用于除去A中挥发出的HCl气体
D.C中装Na2SiO3溶液,预期现象是先出现白色沉淀后又逐渐溶解
难度: 中等查看答案及解析
-
下列反应中,改变反应物的用量或浓度,不会改变生成物的是( )
A.铜与硝酸溶液
B.铁粉在氯气中加热
C.氯化铝溶液与氢氧化钠溶液
D.碘化亚铁溶液中通入氯气
难度: 简单查看答案及解析
-
三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,遇水生成两种常见化合物:NCl3 +3H2O═X+3Y.下列有关其产物说法正确的是( )
A.X是一种温室效应气体
B.从化合价分析X具有典型还原性,常温下易被空气氧化
C.Y是一种比碳酸强的弱酸
D.Y具有强氧化性,能使品红溶液褪色
难度: 中等查看答案及解析
-
100 mL 0.5 mol/L碳酸钠溶液和100 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则关于盐酸的浓度可能是( )
A.0.25 mol/L B.0.5 mol/L C.0.75 mol/L D.1 mol/L
难度: 中等查看答案及解析
-
将0.1 mol的镁、铝混合物溶于100 mL 2 mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液。图中横坐标表示加入NaOH溶液的体积,纵坐标表示生成沉淀的质量,有关说法正确的是( )
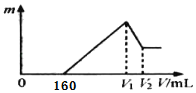
A.V1=400
B.金属粉末中含铝1.35 g
C.最后剩余沉淀质量5.8 g
D.无法确定V2的数值
难度: 中等查看答案及解析
-
现有Fe2O3 、CuO的混合物,在足量H2气流中,加热充分反应,冷却后称得剩余固体比原混合物减轻1.6 g;若将等质量的原混合物与盐酸反应,欲使之完全溶解,需1 mol/L的盐酸的体积至少为( )
A.0.05 L B.0.1 L C.0.2 L D.0.4 L
难度: 中等查看答案及解析