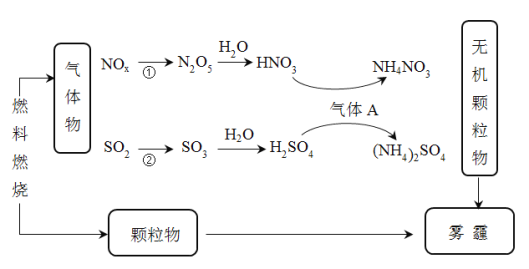
-
2019年国庆各省彩车标志物的主要成分属于无机非金属单质的是( )
A
B
C
D

辽宁彩车

江苏彩车
浙江彩车

江西彩车
基础建设支柱——新中国第一炉钢水
超级计算机核心——我国自主研发的硅芯片
中共一大纪念木船——南湖红船
人间美学瑰宝——青花瓷
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数,下列微粒数量关系正确的是( )
A.2.4 g镁含1.2 NA个电子
B.1 mol钠与水反应生成1 mol H2
C.标况下,22.4 L N2含NA个N原子
D.1 L 0.1 mol/L NH3·H2O溶液含0.1 NA个OH−
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.H2O与H2O2互为同素异形体 B.氡(
)质量数为86
C.CH3CH2OH与CH3OCH3互为同分异构体 D.HCl含非极性共价键
难度: 简单查看答案及解析
-
下列物质可用于处理泄露的有毒物质Na2S的是( )
①铁粉 ②KI ③双氧水 ④臭氧(O3) ⑤NaCl
A.①② B.③④ C.①⑤ D.③⑤
难度: 简单查看答案及解析
-
下列叙述不正确的是( )
A.葡萄糖能发生银镜反应说明其分子结构中含醛基
B.淀粉在体内最终水解为葡萄糖被人体吸收
C.油脂在体内水解生成高级脂肪酸和甘油
D.鸡蛋清遇醋酸铅溶液发生盐析
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W原子序数依次增大,XY2是红棕色气体,Z的周期数等于族序数,W的最外层电子数比次外层电子数少1,下列说法正确的是( )
A.原子半径:X<Y<Z B.气态氢化物的稳定性:Y<X<W
C.最高正价:Z<X<Y<W D.Y、W均可与Na形成离子化合物
难度: 中等查看答案及解析
-
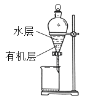
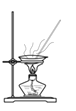
下列实验装置正确且能达到实验目的的是( )
A.实验室制乙酸乙酯

B.比较碳酸与苯酚酸性强弱

C.加入CCl4分离碘水中的碘
D.蒸干FeCl3溶液制无水FeCl3
难度: 中等查看答案及解析
-
阿斯巴甜是一种具有清爽甜味的有机化合物,结构简式如图所示。下列说法不正确的是( )
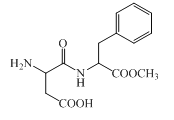
A.分子式为C14H18N2O5
B.不存在顺反异构
C.能发生取代和消去反应
D.1 mol阿斯巴甜完全水解最多消耗3 mol NaOH
难度: 中等查看答案及解析
-
下列解释实验事实的方程式不正确的是
A.铁粉与水蒸气反应产生一种可燃气体:3Fe + 4H2O(g)
Fe3O4 + 4H2
B.NO2能溶于水且溶液显酸性:NO2 + H2O= 2H+ + NO3−
C.氯气能使湿润的有色布条褪色:Cl2+H2O
H+ + Cl− + HClO
D.Na2O2能与水反应产生使带火星的木条复燃的气体:2Na2O2+2H2O== 4Na+ + 4OH− + O2↑
难度: 中等查看答案及解析
-
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )
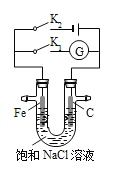
A.K1闭合,K2打开,铁棒上发生的反应为2Cl−−2e−== Cl2↑
B.K1闭合,K2打开,石墨棒周围溶液pH逐渐减小
C.K1打开,K2闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
D.K1打开,K2闭合,电路中通过0.002 mol电子时,两极共产生0.001 mol气体
难度: 困难查看答案及解析
-
通过下列实验能得到相应结论的是( )
实验
结论
A
向某溶液中加入硝酸酸化的BaCl2溶液,生成白色沉淀
该溶液中含SO42−
B
向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色
溶液中一定含有Fe2+
C
向NaBr溶液中滴入少量氯水和CCl4,振荡、静置,溶液下层呈橙红色
Br−还原性强于Cl−
D
常温下,测得Mg(OH)2饱和溶液pH大于Al(OH)3饱和溶液pH
碱性Mg(OH)2>Al(OH)3,金属性Mg>Al
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
2007年诺贝尔化学奖授予埃特尔以表彰其对于合成氨反应机理的研究,氮气和氢气分子在催化剂表面的部分变化过程如图所示,下列说法不正确的是( )
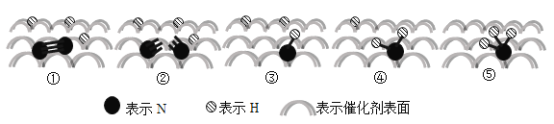
N2(g)+3H2(g)
2NH3(g) △H = −92 kJ/mol
A.升高温度不能提高一段时间内NH3的产率
B.图①→②过程吸热,图②→③过程放热
C.N2在反应过程中三键均发生断裂
D.反应过程中存在−NH−、−NH2等中间产物
难度: 中等查看答案及解析
-
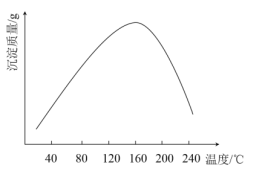
磷酸(H3PO4)是一种中强酸,常温下,H3PO4水溶液中含磷微粒的分布分数(平衡时某微粒的浓度占各含磷微粒总浓度的分数)与pH的关系如图,下列说法正确的是( )
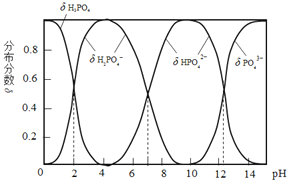
A.H3PO4的电离方程式为:H3PO4
3H++ PO43−
B.pH=2时,溶液中大量存在的微粒有:H3PO4、H2PO4−、HPO42−、PO43−
C.滴加NaOH溶液至pH=7,溶液中c(Na+)= c(H2PO4−)+2c(HPO42−)+3c(PO43−)
D.滴加少量Na2CO3溶液,3Na2CO3+2H3PO4 =2Na3PO4+3H2O+3CO2↑
难度: 困难查看答案及解析
-
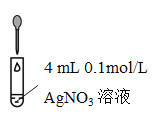
利用如图装置探究铜粉与下列试剂的反应,在试管中加入一定量铜粉,加入试剂后,立即塞上橡胶塞,实验现象如下表所示,下列推断不正确的是( )
资料:Cu2++4NH3
[Cu(NH3)4]2+, [Cu(NH3)4]2+呈绛蓝色。
装置
序号
试剂
现象

①
10 mL浓NH3·H2O,3 mLH2O
溶液变为绛蓝色,左侧水柱上升
②
10 mL浓NH3·H2O,3 mL H2O2
溶液变为绛蓝色,且比①深
③
10 mL 20% HNO3溶液,3 mL H2O
溶液快速变蓝,产生无色气体,左侧水柱下降
④
10 mL 20% HNO3溶液,3 mL H2O2
溶液变蓝比③慢,产生无色气体,左侧水柱下降
A.①中实验现象说明O2参与了反应
B.②中溶液颜色比①深可能是由于H2O2氧化Cu生成Cu2+
C.③中左侧水柱下降可能是反应产生NO气体导致的
D.④比③变蓝慢是由于H2O2分解造成自身消耗
难度: 困难查看答案及解析