-
A、B、C、D、E、F是六种短周期主族元素,其中D、E同主族,C、E同周期,A的核电荷数等于其电子层数,B、D形成的化合物可用于制不粘锅的保护膜,B、E形成的某种化合物是一种常见的有机溶剂,C的次外层电子数是最外层电子数的4倍,D的单质可与水反应置换出F的单质。下列说法不正确的是()
A. 离子半径:E>F>D>C>A
B. 含氧酸的酸性可能为:B>E
C. A、B、F形成的某种化合物可使澄清石灰水变浑浊
D. A与C形成的化合物溶于水显酸性
难度: 中等查看答案及解析
-
化学与社会、生产、生活密切相关,下列说法正确的是( )
A. 汽车尾气中的氮氧化合物是汽油或柴油不完全燃烧造成的
B. 我国全面启动的北斗导航系统的信号传输与硅有关
C. 液氯罐泄漏时,可将其移入水塘中,并向水塘中加入熟石灰
D. 工程兵开山使用的炸药“TNT”是有机高分子化合物
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA
B. 标准状况下,22.4L氖气含有的电子数为10NA
C. 常温下,
的醋酸溶液中含有的
数为
D. 120g NaHSO4分子中阳离子和阴离子的总数为3NA
难度: 中等查看答案及解析
-
降冰片二烯类化合物是一类太阳能储能材料。降冰片二烯在紫外线照射下可以发生下列转化。下列说法错误的是( )

A. 降冰片二烯与四环烷互为同分异构体
B. 降冰片二烯能使酸性高锰酸钾溶液褪色
C. 四环烷的一氯代物超过三种(不考虑立体异构)
D. 降冰片二烯分子中位于同一平面的碳原子不超过4个
难度: 中等查看答案及解析
-
下列离子方程式中正确的是( )
A.向明矾(KAl(SO4)2•12H2O)溶液中滴加Ba(OH)2溶液,恰好使SO42﹣沉淀完全:Al3++2SO42﹣+2Ba2++4OH﹣═AlO2-+2BaSO4↓+2H2O
B.向FeBr2溶液中通入足量Cl2:2Fe2++Cl2=2Fe3++2Cl-
C.AlCl3溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓
D.铜与浓硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
难度: 困难查看答案及解析
-
利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法正确的是( )
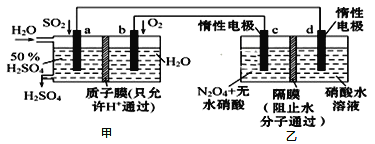
A.电极b反应式是O2+4e-+2H2O=4OH-
B.电解后乙装置d电极附近溶液的pH不变
C.c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D.甲中每消耗1mol SO2,乙装置中有1mol H+通过隔膜
难度: 中等查看答案及解析
-
在25℃时,将1.0L c mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
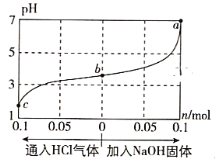
A. 水的电离程度:a>b>c
B. c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
C. a点对应的混合溶液中:c(Na+)=c(CH3COO-)
D. 该温度下,CH3COOH的电离平衡常数
难度: 中等查看答案及解析
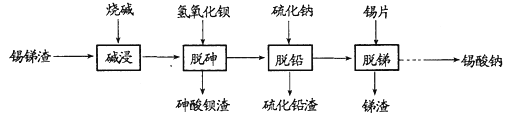
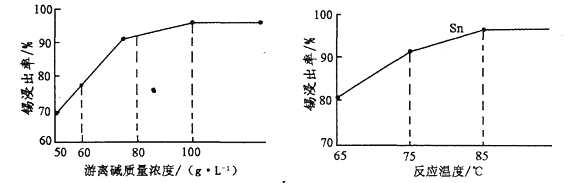
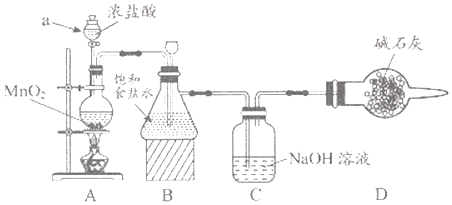
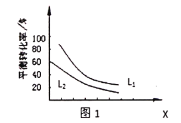

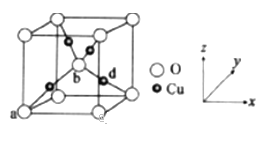
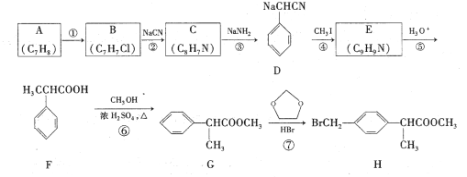
 的合成路线。_______
的合成路线。_______