-
乙醇是重要的化工原料,也是清洁的能源。
Ⅰ、工业上,在一定条件下用乙烯水化法制备乙醇。已知热化学方程式如下:
①CH2=CH2(g)+H2O(g)⇌CH3CH2OH(g) ΔH1
②2CH2=CH2(g)+H2O(g)⇌CH3CH2OCH2CH3(g) ΔH2
③2CH3CH2OH(g)⇌CH3CH2OCH2CH3(g)+H2O(g) ΔH3
(1)几种化学键的键能如下:
| 化学键 | H-C | C=C | H-O | C-O | C-C |
| 键能kJ·mol-1 | 413 | 615 | 463 | 351 | 348 |
根据键能计算ΔH1=________________kJ·mol-1。
(2)在恒容密闭容器中发生反应②,下列能说明该反应达到平衡的是_________。
a、容器中总压强保持不变
b、H2O(g)的消耗速率与CH3CH2OCH2CH3(g)生成速率相等
c、气体平均摩尔质量保持不变
d、容器中气体密度保持不变
(3)在密闭容器中投入CH2=CH2(g)、H2O(g)和催化剂发生反应①,乙烯的平衡转化率与温度、压强的关系如图所示。

①x代表________________。(选填“温度”或“压强”)
②L1和L2哪个大?并请说出理由:_____________________________________________________。
Ⅱ、如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和lmolHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)⇌2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:
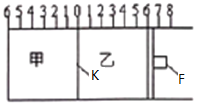
(4)达到平衡时,隔板K最终停留在0刻度左侧某一处,记为a处,则a的取值范围是__________。
(5)若达到平衡时,隔板K最终停留在左侧刻度1处,此时甲容积为2L,则该反应化学平衡常数为_______________。
(6)若一开始就将K、F如上图固定,其他条件均不变,则达到平衡时:测得甲中A的转化率为b,则乙中C的转化率为____________。
-
乙醇是重要的化工原料,也是清洁的能源。
Ⅰ.工业上,在一定条件下用乙烯水化法制备乙醇。已知热化学方程式如下:
①CH2=CH2(g)+H2O(g)⇌CH3CH2OH(g) ΔH1
②2CH2=CH2(g)+H2O(g)⇌CH3CH2OCH2CH3(g) ΔH2
③2CH3CH2OH(g)⇌CH3CH2OCH2CH3(g)+H2O(g) ΔH3
(1)几种化学键的键能如下:
| 化学键 | H−C | C=C | H−O | C−O | C−C |
| 键能kJ·mol−1 | 413 | 615 | 463 | 351 | 348 |
根据键能计算ΔH1=________________kJ·mol−1。
(2)在恒容密闭容器中发生反应②,下列能说明该反应达到平衡的是_________。
a.容器中总压强保持不变
b.H2O(g)的消耗速率与CH3CH2OCH2CH3(g)生成速率相等
c.气体平均摩尔质量保持不变
d.容器中气体密度保持不变
(3)在密闭容器中投入CH2=CH2(g)、H2O(g)和催化剂发生反应①,乙烯的平衡转化率与温度、压强的关系如图所示。
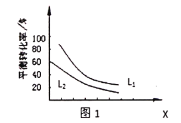
①x代表________________。(选填“温度”或“压强”)
②L1和L2哪个大?并请说出理由:_______________________________。
Ⅱ.如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和lmolHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)⇌2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:

(4)达到平衡时,隔板K最终停留在0刻度左侧某一处,记为a处,则a的取值范围是__________。
(5)若达到平衡时,隔板K最终停留在左侧刻度1处,此时甲容积为2L,则该反应化学平衡常数为_______。
(6)若一开始就将K、F如上图固定,其他条件均不变,则达到平衡时:测得甲中A的转化率为b,则乙中C的转化率为____________。
-
工业上,在一定条件下利用乙烯和水蒸气反应制备乙醇。化学原理:CH2=CH2(g)+H2O(g)→CH3CH2OH(g)△H。已知几种共价键的键能如下表所示:
| 化学健 | C-H | C=C | H-O | C-C | C-O |
| 健能/kJ·mol-1 | 413 | 615 | 463 | 348 | 351 |
下列说法错误的是( )
A. 上述合成乙醇的反应是加成反应
B. 相同时间段内,反应中用三种物质表示的反应速率相等
C. 碳碳双键的键能小于碳碳单键键能的2倍
D. 上述反应式中,△H=-96kJ·mol-1
-
工业上,在一定条件下利用乙烯和水蒸气反应制备乙醇。反应原CH2=CH2(g)+H2O(g)=CH3CH2OH(g )△H。已知几种共价键的键能如下:
| 化学键 | C-H | C=C | H-O | C-C | C-O |
| 键能/kJ·mol-1 | 413 | 615 | 463 | 348 | 351 |
下列说法错误的是
A. 上述合成乙醇的反应原子利用率为100%
B. 相同时间段内,用该反应中三种物质表示的该反应的化学反应速率相等
C. 碳碳双键的键能大于碳碳单键键能,但碳碳单键更稳定
D. 上述反应式中,△H=+34kJ·mol-1
-
天然气( 主要成分为甲烷)是一种高效的清洁能源,也是一种重要的化工原料,利用天然气制备甲醇、乙醇、二甲醚(CH3OCH3)、乙烯(C2H4)等物质的主要反应有:
①CH4(g)+H2O(g)=CO(g)+ 3H2(g) △H1= + 206.2 kJ/ mol
②CO(g)+2H2(g)=CH3OH(g) △H2=- 90.1kJ/ mol
③2CH3OH(g) = CH3OCH3(g) + H2O(g) △H3=- 24.5kJ/ mol
④2CH3OH(g)  C2H4(g) + 2H2O(g) △H4=- 29.1kJ/ mol
C2H4(g) + 2H2O(g) △H4=- 29.1kJ/ mol
⑤CH3OCH3(g)== C2H5OH(g) △H5=- 50.7 kJ /mol
请回答下列问题:
(1)反应2CH4(g)+H2O(g)= C2H5OH(g)+2H2(g)的△H =______kJ/mol;根据化学原理,可 以同时加快该反应的速率和提高甲烷转化率的措施有_______________________。
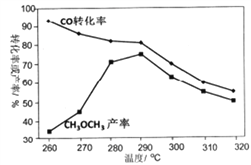
(2)CO与H2在一定条件下,同时发生②和③的反应,产生二甲醚的结果如上图所示。260℃时,CO转化率虽然很高,而二甲醚的产率却很低,可能的原因是 ( 答出一条即可) _______;CO 与H2 合成二甲醚的最佳的温度是_____________。
(3) 对于气体参与的反应如反应④[2CH3OH(g)  C2H4(g) + 2H2O(g)],可以用某组分B的平衡压强(PB)代替物质的量浓度(c)表示平衡常数(Kp),则反应④的平衡常数表达式Kp=____;也可以用压强(PB)变化表示化学反应速率,体积不变的密闭容器中充入一定量的CH3OH气体发生反应④,在10分钟内,容器的压强由xkPa 升高到ykPa,则这段时间该反应的化学反应速率v(CH4)=_____________。
C2H4(g) + 2H2O(g)],可以用某组分B的平衡压强(PB)代替物质的量浓度(c)表示平衡常数(Kp),则反应④的平衡常数表达式Kp=____;也可以用压强(PB)变化表示化学反应速率,体积不变的密闭容器中充入一定量的CH3OH气体发生反应④,在10分钟内,容器的压强由xkPa 升高到ykPa,则这段时间该反应的化学反应速率v(CH4)=_____________。
(4) 反应①~⑤中有多种物质可以做燃料电池的燃料,其中H2是单位质量燃料释放电能最多的物质,若与下列物质构成电池,H2 与_______构成的电池比能量最大。
a.H2O2 b.Cl2 C.O2 d.NiOOH
-
乙烯可作化工原料和清洁能源,研究其制备和综合利用具有重要意义,请回答下列问题:
(1)乙烯的制备:工业上常利用反应C2H6(g) C2H4(g)+H2(g) ΔH制备乙烯。
C2H4(g)+H2(g) ΔH制备乙烯。
已知:Ⅰ.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ΔH1=-1556.8kJ·mol-1;
Ⅱ.H2(g)+ O2(g)=H2O(l) ΔH2=-285.5kJ·mol-1;
O2(g)=H2O(l) ΔH2=-285.5kJ·mol-1;
Ⅲ.C2H6(g)+ O2(g)=2CO2(g)+3H2O(l) ΔH3=-1559.9kJ·mol-1。
O2(g)=2CO2(g)+3H2O(l) ΔH3=-1559.9kJ·mol-1。
则ΔH=______kJ·mol-1。
(2)乙烯可制备乙醇:C2H4(g)+H2O(g) C2H5OH(g)。向2L某恒容密闭容器中充入a mol C2H4(g)和a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如下图所示:
C2H5OH(g)。向2L某恒容密闭容器中充入a mol C2H4(g)和a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如下图所示:

①该反应为______热反应(填“吸”或“放”),理由为____。
②A点时容器中气体的总物质的量为____mol,计算A点对应温度下的平衡常数K=_____(用含a的分数表示)。
③已知:C2H4(g)+H2O(g) C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是____(填选项字母)。
C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是____(填选项字母)。
a.k正增大,k逆减小 b.k正减小,k逆增大c.k正增大的倍数大于k逆 d.k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率_____10%(填“>”、“<”或“=”)。
(3)乙烯可以被氧化为乙醛(CH3CHO),电解乙醛的酸性水溶液可以制备出乙醇和乙酸,则生成乙酸的电极为_____极(填“阴”或“阳”),对应的电极反应式为______。
-
甲烷是一种重要的化工原料和清洁能源,研究其再生及合理利用有重要意义。
请回答:
(1)已知一定条件下发生如下反应:
CO2(g)+2H2O(g) CH4(g)+2O2(g) △H=+802kJ·mol-1。
CH4(g)+2O2(g) △H=+802kJ·mol-1。
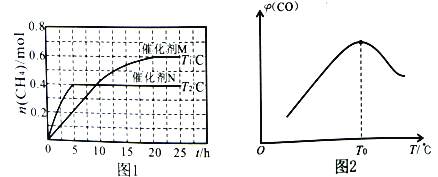
将一定量的CO2(g)和H2O(g)充入10L密闭容器中,分别在催化剂M、N的作用下发生上述反应,CH4(g)的产量(n)与光照时间(t)和温度(T)变化的关系如图1所示。
①若甲烷的燃烧热(△H)为-890kJ·mol-1,则水的汽化热△H=___________。(汽化热指1mol液体转化为气体时吸收的热量)
②T1℃、催化剂M作用下,0~20h内该反应速率v(H2O)=___________。

③根据图1判断,T1___________T2(填“>”“<”或“=”),理由为___________。
催化剂的催化效果:M___________N(填“强于”或“弱于”)。
(2)甲烷可用于制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(
CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数( )与温度(T)的关系如图2所示。
)与温度(T)的关系如图2所示。
①T0℃时,CO的体积分数最大的原因为_________________________________。
②若T0℃时,容器内起始压强为p0,CO的平衡体积分数为10%,则反应的平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
-
甲烷是一种重要的化工原料和清洁能源,研究其再生及合理利用有重要意义。
请回答:
(1)已知一定条件下发生如下反应:
CO2(g)+2H2O(g) CH4(g)+2O2(g) △H=+802kJ·mol-1。
CH4(g)+2O2(g) △H=+802kJ·mol-1。
将一定量的CO2(g)和H2O(g)充入10L密闭容器中,分别在催化剂M、N的作用下发生上述反应,CH4(g)的产量(n)与光照时间(t)和温度(T)变化的关系如图1所示。
①若甲烷的燃烧热(△H)为-890kJ·mol-1,则水的汽化热△H=___________。(汽化热指1mol液体转化为气体时吸收的热量)
②T1℃、催化剂M作用下,0~20h内该反应速率v(H2O)=___________。
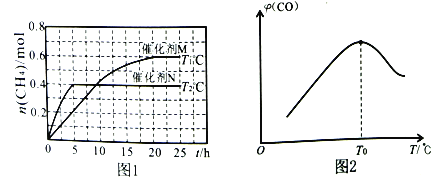
③根据图1判断,T1___________T2(填“>”“<”或“=”),理由为___________。
催化剂的催化效果:M___________N(填“强于”或“弱于”)。
(2)甲烷可用于制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(
CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数( )与温度(T)的关系如图2所示。
)与温度(T)的关系如图2所示。
①T0℃时,CO的体积分数最大的原因为_________________________________。
②若T0℃时,容器内起始压强为p0,CO的平衡体积分数为10%,则反应的平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
-
甲烷是一种重要的化工原料和清洁能源,研究其再生及合理利用有重要意义。
请回答:
(1)已知一定条件下发生如下反应:
CO2(g)+2H2O(g) CH4(g)+2O2(g) △H=+802kJ·mol-1。
CH4(g)+2O2(g) △H=+802kJ·mol-1。
将一定量的CO2(g)和H2O(g)充入10L密闭容器中,分别在催化剂M、N的作用下发生上述反应,CH4(g)的产量(n)与光照时间(t)和温度(T)变化的关系如图1所示。
①若甲烷的燃烧热(△H)为-890kJ·mol-1,则水的汽化热△H=___________。(汽化热指1mol液体转化为气体时吸收的热量)
②T1℃、催化剂M作用下,0~20h内该反应速率v(H2O)=___________。
③根据图1判断,T1___________T2(填“>”“<”或“=”),理由为___________。
催化剂的催化效果:M___________N(填“强于”或“弱于”)。
(2)甲烷可用于制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(
CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数( )与温度(T)的关系如图2所示。
)与温度(T)的关系如图2所示。
①T0℃时,CO的体积分数最大的原因为_________________________________。
②若T0℃时,容器内起始压强为p0,CO的平衡体积分数为10%,则反应的平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
-
乙烯的分子式为C2H4,是一种重要的化工原料和清洁能源,研究乙烯的制备和综合利用具有重要意义。请回答下列问题:
(1)乙烯的制备:工业上常利用反应C2H6(g)=C2H4(g)+H2(g)△H制备乙烯。
已知:Ⅰ.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1556.8kJ·mol-1;
Ⅱ.H2(g)+ O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
Ⅲ.C2H6(g)+ O2(g)=2CO2(g)+3H2O(l) △H3= -1559.9kJ·mol-1。
O2(g)=2CO2(g)+3H2O(l) △H3= -1559.9kJ·mol-1。
则△H=___kJ·mol-1。
(2)乙烯可用于制备乙醇:C2H4(g)+H2O(g)=C2H5OH(g)。向某恒容密闭容器中充入amolC2H4(g)和amol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
①该反应为___热反应(填“吸”或“放”)。
②A点时容器中气体的总物质的量为___。已知分压=总压×气体物质的量分数,用气体分压替代浓度计算的平衡常数叫压强平衡常数(KP),测得300℃时,反应达到平衡时该容器内的压强为bMPa,则A点对应温度下的KP=___MPa-1(用含b的分数表示)。
③已知:C2H4(g)+H2O(g)=C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是___(填选项字母)。
A.k正增大,k逆减小 B.k正减小,k逆增大
C.k正增大的倍数大于k逆 D.k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率___10%(填“>”“<”或“=”)。
(3)乙烯可以被氧化为乙醛(CH3CHO),电解乙醛的酸性水溶液可以制备出乙醇和乙酸,则生成乙酸的电极为____极(填“阴”或“阳”),对应的电极反应式为___。









