-
对于可逆反应:2A(g)+B(g)⇌2C(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A.增大压强 B.升高温度 C.使用催化剂 D.多充入O2
难度: 简单查看答案及解析
-
下列有关电解质溶液的说法正确的是
A.将Ca(ClO)2、Na2SO3、FeCl3溶液蒸干均得不到原溶质
B.保存氯化亚铁溶液时,在溶液中放少量铁粉,以防止Fe2+水解
C.室温下,向0.1mol/L的CH3COOH溶液中加入少量水溶液显碱性的物质,CH3COOH的电离程度一定增大
D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
难度: 中等查看答案及解析
-
下列与化学反应能量变化相关的叙述正确的是( )
A.生成物能量一定低于反应物总能量
B.热化学方程式的化学计量数可表示分子的个数
C.反应热指的是反应过程中放出的热量
D.同温同压下,H2(g)+Cl2(g)= 2HCl(g)在光照和点燃条件的△H相同
难度: 简单查看答案及解析
-
下列说法或表示法正确的是( )
A.等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多
B.由C(金刚石)=C(石墨) ΔH = -119 kJ/mol可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O ΔH =-57.3 kJ/mol,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+ O2(g)=2H2O(l) ΔH = +285.8 kJ/mol
难度: 简单查看答案及解析
-
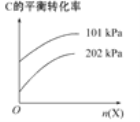
已知反应
。一定条件下,向容积为
的密闭容器中充入
和
,测得
和
的浓度随时间变化的曲线如图所示。下列叙述中正确的是( )
A.升高温度能使
增大
B.反应达到化学平衡时,
的转化率为75%
C.
时,用
表示的正反应的反应速率等于用
表示的逆反应的反应速率
D.从反应开始到反应达到平衡状态,
的平均反应速率
难度: 简单查看答案及解析
-
在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s)+2B(g)⇌ C(g)+D(g)已达到平衡状态( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体总质量 ⑤气体的总物质的量
A.②③⑤ B.①②③ C.②③④ D.①③④⑤
难度: 简单查看答案及解析
-
下列能用勒沙特列原理解释的是( )
A.氯化铁溶液加氢氧化钠振荡后产生红褐色沉淀
B.SO2催化氧化成SO3的反应,往往需要使用催化剂
C.棕红色NO2加压后颜色先变深后变浅
D.H2、I2、HI平衡混和气加压后颜色变深
难度: 简单查看答案及解析
-
已知反应A2(g)+2B2(g)
2AB2(g)的ΔH<0,下列说法正确的是( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
难度: 中等查看答案及解析
-
对于可逆反应N2(g)+3H2(g)
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
A.①压强对反应的影响(p2>p1) B.②温度对反应的影响
C.③平衡体系增加N2对反应的影响 D.④催化剂对反应的影响
难度: 中等查看答案及解析
-
常温下某溶液中由水电离产生的c(H+)=1×10-5mol·L-1,则下列叙述正确的是( )
A.由水电离出的c(OH-)=1×10-9mol•L-1 B.一定是酸溶液
C.可能是强酸的酸式盐溶液 D.pH值可能为9
难度: 简单查看答案及解析
-
右图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列正确的是( )
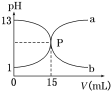
A.盐酸的物质的量浓度为1 mol/L
B.曲线a是盐酸滴定氢氧化钠的滴定曲线
C.P点时反应恰好完全,溶液呈中性
D.酚酞不能作本实验的指示剂
难度: 简单查看答案及解析
-
对于0.1 mol·L-1 Na2SO3溶液,正确的是( )
A.升高温度,溶液的pH降低
B.c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3)
C.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
D.加入少量NaOH固体,c(SO32-)与c(Na+)均增大
难度: 中等查看答案及解析
-
下列关于电解质溶液的叙述正确的是( )
A.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.室温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH小
D.室温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为c(Cl-) = c(NH4+)>c(H+)=c(OH-)
难度: 中等查看答案及解析
-
相同温度,相同物质的量浓度的五种溶液:
① NH4Cl② NaHSO4 ③ NaCl④ CH3COONa ⑤ Na2CO3,pH 按由小到大的顺序排列,正确的是( )
A.⑤<④<③<①<② B.③ <②<①<④<⑤ C.②<①<③<④<⑤ D.② <①<③<⑤<④
难度: 简单查看答案及解析
-
0.02mol·L-1的HCN溶液与0.02mol·L-1的NaCN溶液等体积混合,已知混合液中c(CN-)<c(Na+),则下列关系正确的是( )
A.c(Na+)>c(CN-)>c(H+)> c(OH-) B.c(HCN)+c(CN-)=0.04 mol·L-1
C.2c(Na+)=c(CN-)+c(HCN) D.c(CN-)> c(HCN)
难度: 简单查看答案及解析
-
在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示。下列说法中不正确的是( )

A.T ℃时,在Y点和Z点,Ag2CrO4的Ksp相等
B.a=
×10-5
C.T ℃时,Ag2CrO4的Ksp为1×10-11
D.向饱和Ag2CrO4溶液中加入固体K2CrO4不能使溶液由Y点变为X点图中
难度: 中等查看答案及解析
-
港珠澳大桥的设计使用寿命高达120年,主要的防腐方法有:①钢梁上安装铝片;②使用高性能富锌(富含锌粉)底漆;③使用高附着性防腐涂料;④预留钢铁腐蚀量。下列分析不合理的是( )
A.防腐涂料可以防水、隔离O2,降低吸氧腐蚀速率
B.防腐过程中铝和锌均作为牺牲阳极,失去电子
C.钢铁发生吸氧腐蚀时的负极反应式为:Fe -3e- = Fe3+
D.方法①②③只能减缓钢铁腐蚀,未能完全消除
难度: 中等查看答案及解析
-
下图为直流电源电解稀Na2SO4溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊溶液。下列实验现象中正确的是( )
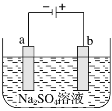
A.一电极逸出无味气体,另一电极逸出刺激性气味气体
B.逸出气体的体积,a电极的大于b电极的
C.a电极附近呈红色,b电极附近呈蓝色
D.a、b电极附近均呈红色
难度: 简单查看答案及解析
-
下列为四个常用的电化学装置,关于它们的叙述正确的是
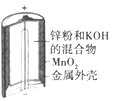
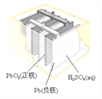
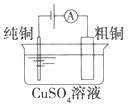
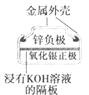
(a)碱性锌锰电池 (b)铅-硫酸蓄电池 (c)电解精炼铜 (d)银锌纽扣电池
A. 图(a)所示电池中,MnO2的作用是催化剂
B. 图(b)所示电池放电过程中,硫酸浓度不断增大
C. 图(c)所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图(d)所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
难度: 中等查看答案及解析
-
2012年6月16日18时37分24秒,神舟九号成功发射。飞船的能量部分来自太阳能电池,另外内部还配有高效的MCFC型燃料电池。该燃料电池可同时供应电和水蒸气,其所用燃料为氢气,电解质为熔融的碳酸钾。已知该燃料电池的总反应为2H2+O2===2H2O,则下列推断正确的是( )
A.电池放电时,电子经外电路由通氧气的正极流向通氢气的负极
B.电池工作时CO32-向正极移动
C.正极的电极反应式为4OH--2e-=O2↑+2H2O
D.负极反应为H2+CO32--2e-=CO2+H2O,
难度: 简单查看答案及解析
-
观察下列几个装置示意图,有关叙述正确的是:

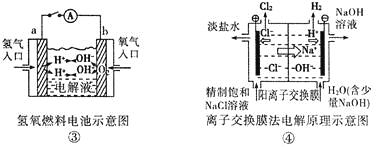
A.装置①中阳极上析出红色固体
B.装置②的待镀铁制品应与电源正极相连
C.装置③闭合电键后,外电路电子由a极流向b极
D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过
难度: 中等查看答案及解析