-
(1)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599kJ·mol-1
根据盖斯定律,写出298K时由石墨和H2(g)生成乙炔的反应的热化学方程式__________________。
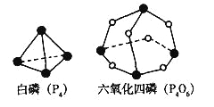
(2)化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示;现提供以下化学键的键能:P-P 198kJ·mol-1、P-O 360kJ·mol-1、氧气分子内氧原子间的键能为498kJ·mol-1。则P4(s)+ 3O2(g) ==P4O6(s)的反应热∆H为______。
(3)下图是一个电化学过程的示意图。

请回答下列问题:
①图中甲池是_______(填“原电池”或“电解池”)。
②A(石墨)电极的名称是_______(填“正极”“负极”“阴极”或“阳极”)。
③写出通入CH3OH的电极的电极反应式:__________________。
④乙池中反应的化学方程式为______________________,当乙池中B(Ag)极质量增加5.4 g,甲池中理论上消耗O2的体积为_________L(标准状况)。
-
(1)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。已知:
C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599 kJ·mol-1
根据盖斯定律,写出298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)热化学方程式:__________________________________________。
(2)在1.0 L真空密闭容器中充入4.0 mol A(g)和4.0 mol B(g),在一定温度下进行反应:A(g)+B(g)⇌C(g) ΔH,测得不同时刻该容器内物质的物质的量如下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(A)/mol | 4.0 | 2.5 | 1.5 | n2 | n3 |
| n(C)/mol | 0 | 1.5 | n1 | 3 | 3 |
回答下列问题:
①随着温度的升高,该反应的化学平衡常数减小,则ΔH___(填“>”“<”或“=”)0,反应从起始到30min内A的平均反应速率是_______,该温度下,上述反应的化学平衡常数为____。
②下列选项中能说明该反应在一定温度和恒容条件下达到平衡状态的是________。
A. 反应速率:vA(正) =vC(逆) B. A的质量和C的质量相等
C. B的转化率不再改变 D. 密度不再改变
(3)若反应C(g)⇌A(g)+B(g)进行时需加入稀释剂X气体(不参与反应),则C的平衡转化率与压强、X的物质的量的关系如图所示。
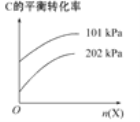
当其他条件不变时,增大X的物质的量,C的平衡转化率将________(填“增大”“减小”或“不变”),其原因是______________________________。
-
(14分)(1)下图是工业氮气和氢气合成1mol氨气过程中能量变化示意图,

请写出该反应的热化学方程式 。
(2)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=C02(g) △H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:△H=____ 。
(3)将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,如下图所示。
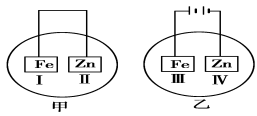
正极上发生的电极反应为___
阴极上发生的电极反应为___
(4)如图是甲烷燃料电池原理示意图,回答下列问题:
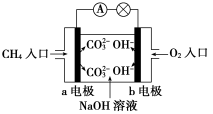
①电池的负极是________(填“a”或“b”)极,负极的电极反应式是 __ _。
②电池工作一段时间后电解质溶液的pH______(填“增大”、“减小”或“不变”)
-
(1)已知单质硫16 g燃烧放热为149 kJ,写出硫燃烧热的热化学方程式:_________________
(2)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知: C(石墨,s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol①
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol③
根据盖斯定律,计算298 K时由C(石墨,s)和H2(g)生成1 mol C2H2(g)反应的焓变:_____________。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ/mol、497 kJ/mol。 N2(g)+O2(g)=2NO(g) ΔH=+180.0 kJ/mol,NO分子中化学键的键能为_____ kJ/mol。
(4)S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g)=SO2(g) ΔH1=-297.16 kJ/mol;
②S(正交,s)+O2(g)=SO2(g) ΔH2=-296.83 kJ/mol;
③S(单斜,s)=S(正交,s) ΔH3=_____。
S(单斜,s)比S(正交,s)更_________(填“稳定”或“不稳定”)
(5)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1 、ΔH2,则ΔH1___________ΔH2。(用“>”、“<”或“=”填空)
(6)相同条件下,2 mol氢原子所具有的能量________1 mol 氢分子所具有的能量。(用“>”、“<”或“=”填空)
-
(16 分) (1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。
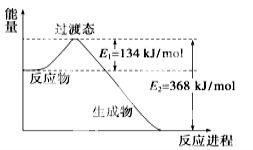
(2))依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) △H1=-394 kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-572 kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2600kJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1 mol C2H2 (g)反应的焓变:
△H=_____ 。
(3) 4.6 g酒精和一定量的氧气混合点燃,恰好完全燃烧,生成5.4 g水和4.48 L CO2(产物均在标准状况下测定),并放出140 kJ热量,写出表示酒精燃烧热的热化学方程式为 。
(4)中和热是指酸跟碱发生中和反应生成l mol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
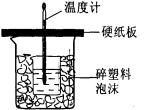
①从实验装置上看,图中尚缺少的一种玻璃用品是___________,烧杯间填满碎塑料泡沫的作用是_________ ________。
②实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),理由是 所求中和热的数值会________(填“相等”或“不相等”)。
-
运用盖斯定律可方便地计算出难以通过实验直接测定的反应热。
已知:①P4(白磷,s)+5O2(g) P4O10(s) ΔH=−2 983.2 kJ·mol−1
P4O10(s) ΔH=−2 983.2 kJ·mol−1
②P(红磷,s)+ O2(g)
O2(g)
 P4O10(s) ΔH=−738.5 kJ·mol−1
P4O10(s) ΔH=−738.5 kJ·mol−1
则白磷转化为红磷的热化学方程式为
A.P4(白磷,s) 4P(红磷,s) ΔH=−29.2 kJ·mol−1
4P(红磷,s) ΔH=−29.2 kJ·mol−1
B.P4(白磷,s) 4P(红磷,s) ΔH=+29.2 kJ·mol−1
4P(红磷,s) ΔH=+29.2 kJ·mol−1
C.P4(白磷,s) 4P(红磷,s) ΔH=−2 244.7 kJ·mol−1
4P(红磷,s) ΔH=−2 244.7 kJ·mol−1
D.P4(白磷,s) 4P(红磷,s) ΔH=+2244.7 kJ·mol−1
4P(红磷,s) ΔH=+2244.7 kJ·mol−1
-
(3分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:298K时,
C(s,石墨)+ O2(g)= CO2(g) △H1= -393.5kJ/mol
2H2(g)+ O2(g)==2H2O (l) △H2= -571.6kJ/mol
2C2H2(g)+ 5O2(g)==4CO2(g) + 2H2O (l) △H3= -2599kJ/mol
写出298K时C(s,石墨)和H2(g)生成1mol C2H2(g)的热化学反应方程式:_____________
-
下列叙述不正确的是
A.热化学方程式中的化学计量数表示物质的量,可以是分数
B.应用盖斯定律可计算某些难以直接测量的反应焓变
C.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
D.已知2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol,则氢气的燃烧热为285.8 kJ/mol
-
下列与化学反应能量变化相关的叙述正确的是
A.生成物能量低于反应物总能量时,反应吸热
B.有热量变化时一定发生了化学变化
C.依据盖斯定律,可计算某些难以直接测定的△H
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H不同
-
下列说法不正确的是
A. 铅蓄电池在放电过程中,负极质量减小,正极质量增加
B. 常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的
C. 应用盖斯定律可计算某些难以直接测量的反应焓变
D. 1g碳与适量水蒸气反应生成 CO和H2,吸收10.94kJ热量,则热化学方程式为:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.28kJ/mol







