-
丝绸之路是沟通东西方文化的友谊之路.下列关于丝绸说法不正确的是
A.“春蚕到死丝方尽“所描述的蚕丝,其主要成分为蛋白质
B.“四川蜀锦”的织锦原料是人造纤维,由加聚反应制得
C.《礼记》记载“天子着青衣”,青色是由丝绸浸染植物染料制得
D.丝绸因富含胺基,氨基等亲水性基团而具有良好的吸湿性
难度: 中等查看答案及解析
-
下列变化中,气体被还原的是
A.水蒸气使CuSO4变蓝 B.Cl2使FeCl2溶液变黄
C.CH2=CH2使溴水褪色 D.H2S使H2SO3溶液变浊
难度: 简单查看答案及解析
-
下列说法错误的是
A.淀粉、葡萄糖都是高分子化合物 B.煤的干馏是复杂的物理、化学变化
C.C3H7C1有2种同分异构体 D.油脂、蛋白质都可以和碱反应
难度: 中等查看答案及解析
-
下列离子能大量共存的一组是
A.Fe3+、Cu2+、SO42—、NO3— B.HCO3—、K+、Cl—、 [Al(OH)4]—
C.Na+、Al3+、Br—、S2— D.ClO—、Mg2+、SO42—、I—
难度: 中等查看答案及解析
-
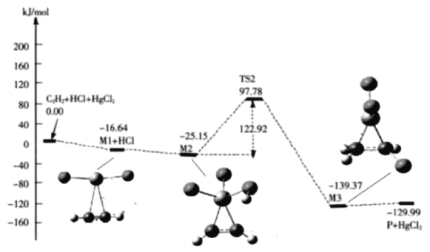
两个铷钾分子在温度为5×10-7K时反应,超冷温度迫使反应在中间阶段停留了几微秒,人类第一次见证了化学反应过程,其过程如图所示,下列说法正确的是

A.K+的结构示意图为
B.铷元素位于第4周期IA族
C.该反应为吸热反应 D.该反应获得了化学键断裂和形成的证据
难度: 简单查看答案及解析
-
Weiss利用光敏剂QD制备2-环己基苯乙烯(c)的过程如图所示.下列有关说法正确
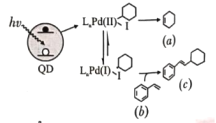
A.a不能使酸性KMnO4溶液褪色 B.1mol b最多能与4mol H2加成
C.c分子中所有原子共平面 D.a、b、c均易溶于水
难度: 中等查看答案及解析
-
用如图所示装置进行下列实验,其中不合理的是

A.用CCl4萃取碘水中的碘 B.用NaOH溶液除去溴苯中的溴
C.用水除去硬脂酸钠中的甘油 D.用饱和Na2CO3溶液除去乙酸乙酯中的乙酸
难度: 中等查看答案及解析
-
设阿伏加德罗常数的值为NA、利用反应2MgO+Si
2Mg↑+SiO2获取镁,每生成1mol Mg时,下列说法不正确的是
A.消耗的MgO质量为40g B.断裂Si-Si键的数目为NA
C.转移的电子数为2NA D.生成镁蒸气体积为22.4L
难度: 中等查看答案及解析
-
用如图实验装置(夹持仪器己略去)探究铁与浓硫酸的反应,下列实验不合理的是

A.上下移动①中的铁丝可控制生成SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认产物中铁元素的价态,向①中加水,观察颜色变化
难度: 中等查看答案及解析
-
利用Al-PMOF可快速将芥子气降解为无毒物质,其结构如图。其中X、Y、Z为短周期元素且原子序数依次增大,X、Y同主族。下列说法正确的是
A.简单离子半径:Z>Y>X B.最简单氢化物稳定性:Z>Y>X
C.含氧酸酸性:Z>Y D.YXZ2中Y的化合价为+4
难度: 中等查看答案及解析
-
如图,将一根纯铁棒垂直没入水中,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重.下列关于此现象的说法不正确的是

A.铁棒AB段的溶解氧浓度高于BC段
B.铁棒AB段电极反应为O2+2H2O+4e-=4OH-
C.铁棒AB段的Fe2+浓度高于BC段
D.该腐蚀过程属于电化学腐蚀
难度: 中等查看答案及解析
-
电催化N2还原制NH3的一种反应机理如图所示,其中吸附在催化剂表面的物种用*表示,下列说法不正确的是
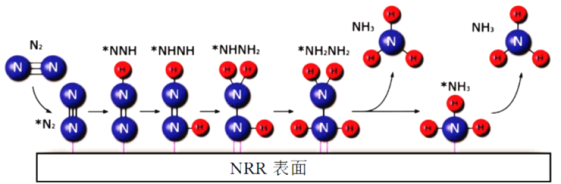
A.N2生成NH3是通过多步还原反应实现的
B.两个氮原子上的加氢过程同时进行
C.析氢反应(H*+H*→H2)会影响NH3的生成
D.NH3的及时脱附有利于增加催化剂活性位
难度: 中等查看答案及解析
-
某水系锂离子电池可实现Li+和Co2+分离回收,其装置如图。25℃时,Co(OH)2的Ksp分别为6.31×10—15,LiOH的溶解度为12.7g.下列说法不正确的是
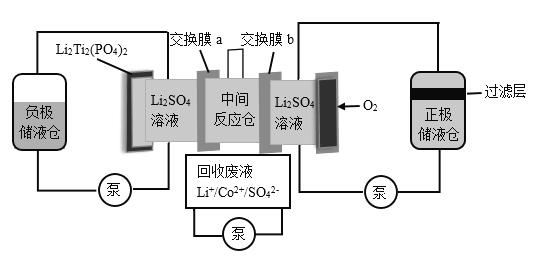
A.负极材料中发生变价的元素是Ti
B.交换膜a为阳离子交换膜
C.负极液和正极液中的c(Li+)均变大
D.在过滤层可收集到Co(OH)2
难度: 困难查看答案及解析
-
25℃时,CaCO3、CaC2O4的Ksp分别为3.4×10—9和2.3×10—9,醋酸、HCN的Ka分别为1.75×10—5和4.9×10—10,分离CaCO3和CaC2O4固体混合物(不要求复原)。应选择的试剂为
A.盐酸 B.硝酸 C.乙酸 D.HCN
难度: 中等查看答案及解析
-
将0.48g镁粉分别加入10.0mL下列溶液,反应6小时,用排水法收集产生的气体,溶液组成与H2体积(已换算成标准状况)的关系如下表。下列说法不正确的是
实验
1
2
3
4
5
6
7
溶液组成
H2O
1.0mol/L NH4Cl
0.1mol/L NH4Cl
1.0mol/L NaCl
1.0mol/L NaNO3
0.8mol/L NH4Cl+
0.2mol/L NH3·H2O
0.2mol/L NH4Cl+
0.8mol/L NH3·H2O
V/ml
12
433
347
160
14
401
349
A.由实验2、3可得,
浓度越大,镁和水反应速率越快
B.由实验1、4、5可得,Cl-对镁和水的反应有催化作用
C.由实验3、7可得,反应过程产生的Mg(OH)2覆盖在镁表面,减慢反应
D.无论酸性条件还是碱性条件,
都能加快镁和水的反应
难度: 中等查看答案及解析

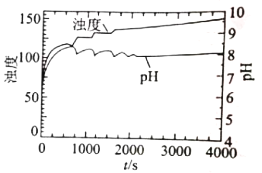
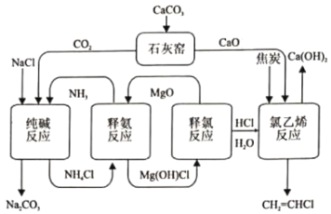
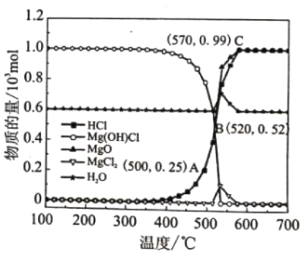
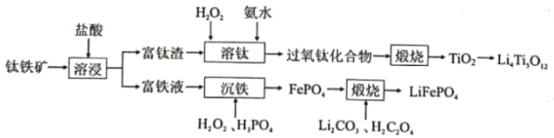


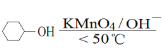 KOOC(CH2)4COOK ΔH<0
KOOC(CH2)4COOK ΔH<0