-
下列实验操作正确或实验设计能达到实验目的的是( )

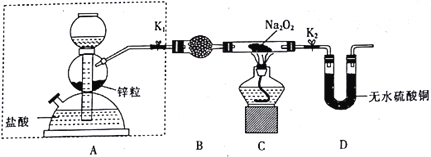
A.证明钠的密度小于水的密度但大于煤油的密度
B.制备氢氧化铁胶体
C.利用过氧化钠与水反应制备氧气,且随开随用、随关随停
D.证明氯气具有漂白性
难度: 中等查看答案及解析
-
下列化学用语表示正确的是
A. 中子数为8的氮原子:
B. 硫离子的结构示意图:
C. 铵根离子的电子式:
D. 聚丙烯的结构简式
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值,下列有关叙述正确的是
A. 标准状况下,5.6L 一氧化氮和5.6L 氧气混合后的分子总数为0.5NA
B. 等体积、浓度均为1mol/L的磷酸和盐酸,电离出的氢离子数之比为3:1
C. 一定温度下,1L 0.50 mol/L NH4Cl溶液与2L 0.25 mol/L NH4Cl溶液含NH4+的物质的量不同
D. 标准状况下,等体积的N2和CO所含的原子数均为2NA
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )
A.常温下,由水电离的c(H+)=10-13 mol·L-1的溶液中:Na+、NH4+、Cl-、HCO3-
B.酸性碘化钾溶液中滴加适量双氧水:2I— 2H+ H2O2=I2 2H2O
C.氢氧化钡溶液与硫酸铜溶液反应:Ba2++SO42—=BaSO4
D.向饱和碳酸钠溶液中通入二氧化碳:CO32— CO2 H2O=2HCO3—
难度: 中等查看答案及解析
-
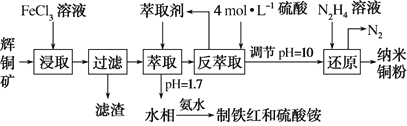
下列有关物质性质的叙述错误的是
A. 将过量氨气通入CuSO4溶液中可得深蓝色溶液
B. 蛋白质溶于水所得分散系可产生丁达尔效应
C. 硅酸钠溶液与稀盐酸反应可生成硅酸胶体
D. 过量铁粉在氯气中燃烧可生成氯化亚铁
难度: 困难查看答案及解析
-
如表为元素周期表的一部分。X、Y、Z、W为短周期元素,其中Y元素的原子最外层电子数是其电子层数的3倍。下列说法正确的是( )
X
Y
Z
W
T
A. Y的氢化物的沸点一定比X氢化物的沸点高
B. Z的氧化物对应的水化物酸性比W的弱
C. ZY2、XW4与Na2Z的化学键类型相同
D. 根据元素周期律,可以推测存在TZ2和TW4
难度: 中等查看答案及解析
-
实验室为监测空气中汞蒸气的含量,通常悬挂有CuI的滤纸,根据滤纸是否变色或颜色发生变化的时间来判断空气中汞的含量,其反应为:4CuI+Hg=Cu2HgI4+2Cu。下列有关说法正确的是( )
A. 上述反应的产物Cu2HgI4中,Hg的化合价为+2
B. 上述反应中CuI既是氧化剂,又是还原剂
C. 上述反应中Hg元素与Cu元素均被氧化
D. 上述反应中生成64gCu时,转移的电子数为2NA
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
B.向NaNO2溶液中滴加酸性KMnO4溶液:5NO2-+2MnO4-+3H2O=5NO3- +2Mn2++6OH-
C.向AlCl3溶液中滴加过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
难度: 困难查看答案及解析
-
下列物质的转化在给定条件下不能实现的是( )
A.NH3
NO
HNO3
B.浓盐酸
Cl2
漂白粉
C.Al2O3
AlCl3(aq)
无水AlCl3
D.葡萄糖
C2H5OH
CH3CHO
难度: 简单查看答案及解析
-
下列说法正确的是
A. 铜锌原电池中,盐桥中的K+和NO
分别移向负极和正极
B. SiO2(s)+2C(s)===Si(s)+2CO(g)必须在高温下反应才能发生,则ΔH>0
C. 室温下,将Na2CO3和NaHCO3的混合溶液加水稀释,
减小
D. 电解精炼铜时,若阴极析出3.2 g铜,则阳极失电子数大于6.02×1022
难度: 困难查看答案及解析
-
下列有关化合物X的叙述正确的是
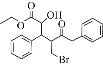
A. X分子只存在2个手性碳原子
B. X分子能发生氧化、取代、消去反应
C. X分子中所有碳原子可能在同一平面上
D. 1 mol X与足量NaOH溶液反应,最多消耗3 mol NaOH
难度: 困难查看答案及解析
-
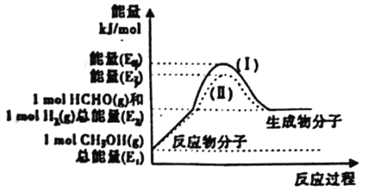
图1为CO2与CH4转化为CH3COOH的反应历程(中间体的能量关系如虚框中曲线所示),图2为室温下某溶液中CH3COOH和CH3COO-两种微粒浓度随pH变化的曲线。下列结论错误的是

A.CH4分子在催化剂表面会断开C—H键,断键会吸收能量
B.中间体①的能量大于中间体②的能量
C.室温下,CH3COOH的电离常数Ka=10-4.76
D.升高温度,图2中两条曲线交点会向pH增大方向移动
难度: 困难查看答案及解析
-
化学可以变废为室,利用电解法处理烟道气中的NO,将其转化为NH4NO3的原理如下图所示,下列说法错误的是
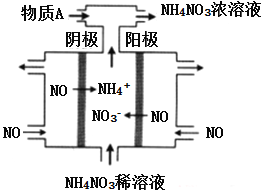
A. 该电解池的阳极反反为:NO-3e-+2H2O=NO3-+4H+
B. 该电解池的电极材料为多孔石墨,目的是提高NO的利用率和加快反应速率
C. 用NH4NO3的稀溶液代替水可以增强导电能力,有利于电解的顺利进行
D. 为使电解产物全部转化为NH4NO3,需补充物质A为HNO3
难度: 中等查看答案及解析
-
已知磷酸分子(
 )中的三个氢原子都可以与重水分子(D2O)中的D原子发生氢交换。又知次磷酸( H3 PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能与D2O发生氢交换。下列说法正确的是
)中的三个氢原子都可以与重水分子(D2O)中的D原子发生氢交换。又知次磷酸( H3 PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能与D2O发生氢交换。下列说法正确的是A. H3 PO2属于三元酸 B. H3 PO2的结构式为
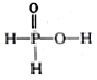
C. NaH2PO2属于酸式盐 D. NaH2PO2溶液可能呈酸性
难度: 困难查看答案及解析
-
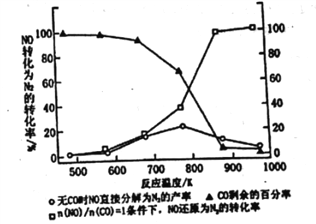
已知反应:
生成
的初始速率与NO、
的初始浓度的关系为
,k是为速率常数。在
时测得的相关数据如下表所示。下列说法不正确的是
实验数据
初始浓度
生成
的初始速率mol/(L·s)
1
2
3
A.关系式中
、
B.
时,k的值为
C.若
时,初始浓度
mol/L,则生成
的初始速率为
mol/(L·s)
D.当其他条件不变时,升高温度,速率常数是将增大
难度: 中等查看答案及解析