-
[化学选修3物质结构与性质]
自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。
(1)请写出Fe的基态原子核外电子排布式 。
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
则A原子的价电子排布式为 。
(3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac-代表CH3COO-),其反应是:[Cu(NH3)2]Ac+CO+NH3 [Cu(NH3)3CO]Ac[醋酸羰基三安合铜(I)] △H<0
[Cu(NH3)3CO]Ac[醋酸羰基三安合铜(I)] △H<0
①C、N、O三种元素的第一电离能由小到大的顺序为
②配合物[Cu(NH3)3CO]Ac中心原子的配位数为
③在一定条件下NH3与CO2能合成尿素[CO(NH2)2],尿素中C原子和N原子轨道的杂化类型分别为 ;1mol尿素分子中,σ键的数目为 NA。
(4)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是 。
(5)(NH4)2SO4、NH4NO3等颗粒物及扬尘等易引起雾霾。其中NH4+的空间构型是 (用文字描述),与NO3-互为等电子体的分子是 。(填化学式)
(6)铜的化合物种类很多,右图是氯化亚铜的晶胞结构,已知晶胞的棱长为a cm,则氢化亚铜密度的计算式为ρ= g/cm3.(用NA表示阿佛加德罗常数)
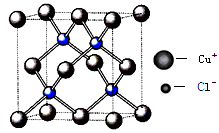
-
自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。
(1)请写出Fe的基态原子核外电子排布式____________。
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
| 电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15 390 | 21 771 |
则A原子的价电子排布式为______________。
(3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(Ⅰ)溶液来吸收原料气体中的CO(Ac—代表CH3COO—),其反应是:[Cu(NH3)2]Ac+CO+NH3 [Cu(NH3)3CO]Ac[醋酸羰基三氨合铜(Ⅰ)] ΔH<0。
[Cu(NH3)3CO]Ac[醋酸羰基三氨合铜(Ⅰ)] ΔH<0。
①C、N、O三种元素的第一电离能由小到大的顺序为____________。
②配合物[Cu(NH3)3CO]Ac中心原子的配位数为____________。
③在一定条件下NH3与CO2能合成尿素[CO(NH2)2],尿素中C原子和N原子轨道的杂化类型分别为________;1 mol尿素分子中,σ键的数目为________。
(4)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3 ℃,MgO的熔点高达2800 ℃。造成两种晶体熔点差距的主要原因是____________________________________。
(5)(NH4)2SO4、NH4NO3等颗粒物及扬尘等易引起雾霾。其中NH4+的空间构型是____________(用文字描述),与NO互为等电子体的分子是____________(填化学式)。
(6)铜的化合物种类很多,如图是氯化亚铜的晶胞结构(黑色球表示Cu+,白色球表示Cl-),已知晶胞的棱长为a cm,则氯化亚铜密度的计算式为ρ=________g·cm-3(用NA表示阿伏加德罗常数)。
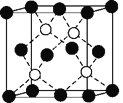
-
自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。
(1)请写出Fe的基态原子核外电子排布式____________。
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
| 电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15 390 | 21 771 |
则A原子的价电子排布式为______________。
(3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(Ⅰ)溶液来吸收原料气体中的CO(Ac—代表CH3COO—),其反应是:[Cu(NH3)2]Ac+CO+NH3 [Cu(NH3)3CO]Ac[醋酸羰基三氨合铜(Ⅰ)] ΔH<0。
[Cu(NH3)3CO]Ac[醋酸羰基三氨合铜(Ⅰ)] ΔH<0。
①C、N、O三种元素的第一电离能由小到大的顺序为____________。
②配合物[Cu(NH3)3CO]Ac中心原子的配位数为____________。
③在一定条件下NH3与CO2能合成尿素[CO(NH2)2],尿素中C原子和N原子轨道的杂化类型分别为________;1 mol尿素分子中,σ键的数目为________。
(4)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3 ℃,MgO的熔点高达2800 ℃。造成两种晶体熔点差距的主要原因是____________________________________。
(5)(NH4)2SO4、NH4NO3等颗粒物及扬尘等易引起雾霾。其中NH4+的空间构型是____________(用文字描述),与NO互为等电子体的分子是____________(填化学式)。
(6)铜的化合物种类很多,如图是氯化亚铜的晶胞结构(黑色球表示Cu+,白色球表示Cl-),已知晶胞的棱长为a cm,则氯化亚铜密度的计算式为ρ=________g·cm-3(用NA表示阿伏加德罗常数)。
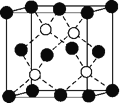
-
自然界中存在大量的金属元素和非金属元素,它们在工农业生产中有着广泛的应用。
(1)纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,已知高温下Cu2O比CuO稳定。
①画出基态Cu原子的价电子轨道排布图____________;
②从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因____________。
(2)CuSO4溶液常用作农药、电镀液等,向CuSO4溶液中滴加足量浓氨水,直至产生的沉淀恰好溶解,再向其中加入适量乙醇,可析出深蓝色的Cu(NH3)4SO4·H2O晶体。
①Cu(NH3)4SO4·H2O晶体中存在的化学键有____________(填字母序号)。
a.离子键 b.极性键 c.非极性键 d.配位键
②SO42—的立体构型是____________,其中S原子的杂化轨道类型是____________。
③已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是__________________。
(3)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是____________。
(4)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac-代表CH3COO-),该反应是:
[Cu(NH3)2]Ac+CO+NH3 [Cu(NH3)3CO]Ac(醋酸羰基三氨合铜)(I) △H<0
[Cu(NH3)3CO]Ac(醋酸羰基三氨合铜)(I) △H<0
①C、N、O三种元素的第一电离能由小到大的顺序为____________;
②配合物[Cu(NH3)3CO]Ac中心原子的配位数为_________。
(5)铜的化合物种类很多,右图是氯化亚铜的晶胞结构,已知晶胞的棱长为a cm,则氯化亚铜密度的计算式为:ρ=____________g/cm3(用NA表示阿伏加德罗常数)。
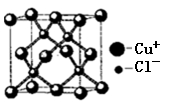
-
自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子核外电子排布式为__________,N、O、S元素的原子对键合电子吸引力最大的是___________。
(2)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,1mol CN−中含有的π键的数目为__________。与CN−互为等电子体的离子或分子有__________(写出一种即可)。
(3)[Cu(NH3)4]2+中,提供孤对电子的是___________。Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是___________(填“极性”或“非极性”)分子,由此推知[Cu(NH)4]2+的空间构型是___________。(填“平面正方形”或“正四面体”)
(4)NH3中N原子的杂化方式是___________,硫元素对应的含氧酸酸性是H2SO4强于H2SO3,其原因为___________。
(5)铜的一种氧化物晶体结构如图所示,该氧化物的化学式是___________。若该晶体结构为长方体,其参数如图,阿伏加德罗常数为NA,则该氧化物的密度为___________g/cm3。
-
【选修3:物质结构与性质】自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子核外电子排布式为_________,C、N、O三种元素的第一电离能由大到小的顺序为_________。
(2)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2−, 1 mol CN−中含有的π键的数目为_________。与CN−互为等电子体的分子有_______ (写出一种即可)。
(3)在络离子[Cu(NH3)4] 2+中 NH3 的 VSEPR 模型为____________,其中N原子的杂化轨道类型为_________。
(4)NaCl和MgO都属离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是_______________________。
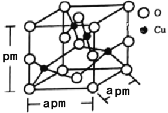
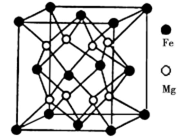
(5)晶体是由无数晶胞___________而成。铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。则铁镁合金的化学式为______,若该晶胞的晶胞参数为d nm,则该合金的密度为______g/cm3 (不必化简,用NA表示阿伏加德罗常数)。
-
自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子核外电子排布式为_________,S、O、N三种元素的电负性由大到小的顺序为_________。
(2)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2−,CN−中提供孤电子对的原子是______,1 mol CN−中含有的π键的数目为_________。与CN−互为等电子体的离子有_________ (写出一种即可)。
(3)已知AlCl3的蒸气是缔合的双分子(Al2Cl6),更高温度下Al2Cl6则离解生成AlCl3单分子。单分子AlCl3的立体构型是________,缔合双分子Al2Cl6中Al原子的杂化轨道类型为_________。
(4)NaCl和MgO都属离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是_____。
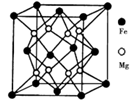
(5)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。则铁镁合金的化学式为________,若该晶胞的参数为d nm,则该合金的密度为____________ g/cm3 (不必化简,用NA表示阿伏加德罗常数)。
-
自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子核外电子排布式为_________,S、O、N三种元素的电负性由大到小的顺序为_________。
(2)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2−,CN−中提供孤电子对的原子是________,1 mol CN−中含有的π键的数目为_________。与CN−互为等电子体的离子有_________ (写出一种即可)。
(3)已知AlCl3的蒸气是缔合的双分子(Al2Cl6),更高温度下Al2Cl6则离解生成AlCl3单分子。单分子AlCl3的立体构型是________,缔合双分子Al2Cl6中Al原子的杂化轨道类型为_________。
(4)NaCl和MgO都属离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是_____。
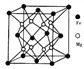
(5)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。则铁镁合金的化学式为______,若该晶胞的参数为d nm,则该合金的密度为________g/cm3 (不必化简,用NA表示阿伏加德罗常数)。
-
自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子核外电子排布式为_________,S、O、N三种元素的电负性由大到小的顺序为_________。
(2)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2−,CN−中提供孤电子对的原子是________,1 mol CN−中含有的π键的数目为_________。与CN−互为等电子体的离子有_________ (写出一种即可)。
(3)已知AlCl3的蒸气是缔合的双分子(Al2Cl6),更高温度下Al2Cl6则离解生成AlCl3单分子。单分子AlCl3的立体构型是________,缔合双分子Al2Cl6中Al原子的杂化轨道类型为_________。
(4)NaCl和MgO都属离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是_____。
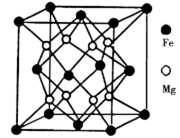
(5)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。则铁镁合金的化学式为______,若该晶胞的参数为d nm,则该合金的密度为________g/cm3 (不必化简,用NA表示阿伏加德罗常数)。
-
自然界中存在大量的金属元素,在工农业生产中有着广泛的应用。回答下列问题:
(1)焰色反应的光谱属于发射光谱,铜和含铜离子化合物的焰色为_______色。
(2)基态Ni原子中,核外电子占据的最高能层符号是________,其核外电子排布式中未成对电子数为_________个。
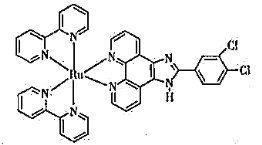
(3)钌-多吡啶配合物具有丰富的光化学和光物理信息,结构简式如下图所示。钌(Ⅱ)的配位数是_______,N原子的杂化类型为______________。
(4) 晶体中,
晶体中, 的重复排列方式如图所示,该排列方式中存在着如由1、3、6、7的
的重复排列方式如图所示,该排列方式中存在着如由1、3、6、7的 围成的正四面体空隙和3、6、7、8、9、12的
围成的正四面体空隙和3、6、7、8、9、12的 围成的正八面体空隙。
围成的正八面体空隙。 中有一半的
中有一半的 填充在正四面体空隙中,另一半
填充在正四面体空隙中,另一半 和全部
和全部 填充在正八面体空隙中,则
填充在正八面体空隙中,则 晶体中,正八面体空隙数与
晶体中,正八面体空隙数与 数之比为__________。正四面体空隙填充率与正八面体空隙填充率之比为________。
数之比为__________。正四面体空隙填充率与正八面体空隙填充率之比为________。 晶胞中有8个图示结构单元,该晶胞参数为a pm,则晶体密度为________
晶胞中有8个图示结构单元,该晶胞参数为a pm,则晶体密度为________ (写出含a和
(写出含a和 的计算表达式)。
的计算表达式)。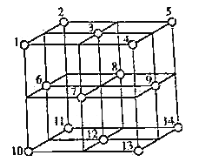
[Cu(NH3)3CO]Ac[醋酸羰基三氨合铜(Ⅰ)] ΔH<0。










