-
下列对生产、生活中的有关问题认识正确的是
A.漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的
B.采用催化转换技术不能提高汽车尾气中有害气体的转化率
C.食品中加抗氧化剂可延长保质期,这与反应速率无关
D.氢氧燃料电池、铅蓄电池、硅太阳能电池中都利用了原电池原理
难度: 中等查看答案及解析
-
下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
难度: 中等查看答案及解析
-
下列说法中,正确的是:
A.对于△S>0的反应,若在任何条件下均能自发进行,则该反应△H>0
B.pH=2和pH=4的两种酸混合,其混合后溶液的pH一定在2到4之间
C.合成氨反应: N2(g)+3H2(g) ⇌ 2NH3(g)△H<0,升高温度有利于提高反应物的转化率
D.氢氧燃料电池比氢气直接在空气中燃烧发电,能量转换率高
难度: 中等查看答案及解析
-
下列实验操作,能有效改变反应速率且达到变化要求的是
A.为增大泡沫灭火器中Al2(SO4)3与小苏打的反应速率,改用小苏打和苏打的混合物
B.为加快盐酸和过量锌粒制取氢气的速率又不减少氢气的量,可加少量硝酸银溶液
C.在稀硫酸和铁粉反应制取氢气时,为减慢反应速率,可以加入适量醋酸钠
D.用3 mL乙醇、2 mL浓H2SO4、2 mL冰醋酸制乙酸乙酯,为增大反应速率,可改用6 mL乙醇、4 mL浓H2SO4、4 mL冰醋酸
难度: 中等查看答案及解析
-
反应N2O4(g)
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是
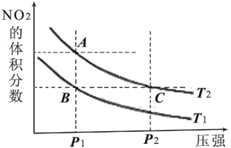
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.A、B两点气体的平均相对分子质量:A>B
D.B、C两点化学平衡常数:B<C
难度: 中等查看答案及解析
-
t°C时,在一未知体积的密闭容器中充入2molA和3molB,发生如下化学反应: aA(g)+B(g)
C(g)+D(g),已知其化学平衡常数为1,在温度不变的情况下,扩大容器容积至原来10倍,结果A的百分含量始终未有改变,则此时B的转化率是( )
A.40% B.60% C.50% D.无法确定
难度: 中等查看答案及解析
-
对于可逆反应:A2(g)+3B2(g)
2AB3(正反应放热),下列图象中正确的是
A.
B.
C.
D.
难度: 困难查看答案及解析
-
下列有关电解质溶液的说法正确的是( )
A.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中
不变
B.将CH3COONa溶液从20℃升温至30℃,溶液中
增大
C.向盐酸中加入氨水至中性,溶液中
>1
D.向0.1mol•L-1CH3COOH 溶液中加入少量水,溶液中
减小
难度: 困难查看答案及解析
-
下图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是
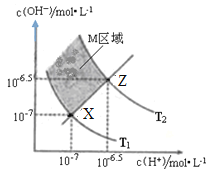
A.两条曲线间任意点均有c(H+)×c(OH-)=Kw
B.M区域内任意点均有c(H+)<c(OH-)
C.图中T1<T2
D.XZ线上任意点均有pH=7
难度: 中等查看答案及解析
-
下列说法正确的是
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.用0.2000 mol·L -1NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol·L -1),至中性时,溶液中的酸未被完全中和
D.体积相同、pH相同的醋酸和盐酸完全溶解足量的镁粉,产生等量的氢气
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1NaOH溶液:K+、Na+、AlO2-、CO32-
B.0.1 mol·L-1Na2CO3溶液:K+、Al3+、NO3-、Cl-
C.pH=3.5的溶液:K+、NH4+、I-、Fe3+
D.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO3-
难度: 中等查看答案及解析
-
下列表达式书写正确的是( )
A.NaHCO3的电离方程式:NaHCO3=Na++H++CO32-
B.HS-的水解方程式:HS-+H2O
H3O++S2-
C.CO32-的水解方程式:CO32-+2H2O
H2CO3+2OH-
D.BaSO4的沉淀溶解平衡表达式:BaSO4(s)
Ba2+(aq)+SO42-(aq)
难度: 中等查看答案及解析
-
某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是
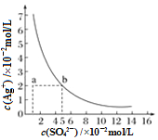
A.含有大量SO42-的溶液中肯定不存在Ag+
B.Ag2SO4的溶度积常数(Ksp)为1×10-3
C.0.02 mol·L-1的AgNO3溶液与0.02 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
D.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点
难度: 中等查看答案及解析
-
下列溶液中各微粒的浓度关系正确的是
A.pH=4的盐酸中:c(H+)=4.0 mol·L-1
B.CH3COONa溶液中:c(CH3COO-)=c( Na+ )
C.NaCl溶液中:c( Na+ )= c(Cl-)
D.NaHCO3溶液中:c( Na+)+ c(H+) =c(HCO3-)+c(OH-)+ c(CO32-)
难度: 中等查看答案及解析
-
为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D−Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D−Zn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)
ZnO(s)+2Ni(OH)2(s)。下列说法错误的是
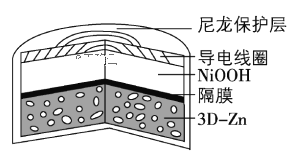
A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B.放电过程中OH−通过隔膜从负极区移向正极区
C.充电时阴极反应为ZnO(s)+H2O(l) +2e−= Zn(s)+2OH−(aq)
D.放电时正极反应为NiOOH(s)+H2O(l) +e− =Ni(OH)2(s)+OH−(aq)
难度: 中等查看答案及解析
-
图所示装置中,甲、乙、丙三个烧杯依次分别盛放NaOH溶液、足量的CuSO4溶液和足量的 K2SO4溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加6.4g。以下说法不正确的是:

A.电源的N端为正极
B.电极b上发生的电极反应为4OH--4e-=2H2O+O2↑
C.b电极上生成气体1.12L,e电极上生成气体0.2 g
D.如果电解过程中铜全部析出,此时电解继续进行
难度: 中等查看答案及解析
 =
=