-
化学与生产、生活密切联系。下列说法正确的是
A. 食品包装中使用生石灰或硅胶可吸收水分使食品保持干燥
B. 将化工厂排放废气的烟囱加高可减少烟尘对环境的污染
C. 将家用84消毒液与洁厕灵混合使用可提高去污效果
D. 向海水中加明矾可使海水淡化
难度: 简单查看答案及解析
-
分子式为C4H10O的醇与分子式为C4H8O2的羧酸发生酯化反应,生成酯的结构可能有(不考虑立体异构)
A. 4种 B. 6种 C. 8种 D. 10种
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 100 mL 0.2 mol·L-1蔗糖溶液中所含分子总数为0. 02 NA
B. 40 mL 10 mol·L-1的浓盐酸与足量的MnO2充分反应,生成氯气的分子数为0.1 NA
C. 标准状况下,22.4 L CHCl3中含有的氯原子数目为3 NA
D. 14 g CO和N2混合气体中含有的电子总数为7 NA
难度: 中等查看答案及解析
-
下列实验操作、实验现象及对应的实验结论都正确的一组是
选项
实验操作
实验现象
实验结论
A
将CO2通入CaCl2溶液中
产生白色沉淀
CaCO3难溶于水
B
向某溶液滴加少量稀盐酸
溶液中出现白色沉淀
该溶液中一定存在Ag+
C
向AgCl沉淀中滴加NaBr溶液
白色沉淀转化为浅黄色沉淀
Ksp( AgCl)>Ksp (AgBr)
D
将苯滴加到溴水中
溴水褪色
苯和溴发生了取代反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
A、B、C、D为短周期主族元素,25℃时,其最高价氧化物的水化物溶液(浓度均为0.1mol·L-1) 的pH和原子序数的关系如图所示。下列有关说法正确的是

A. 简单离子半径:D离子>C离子>A离子>B离子
B. D元素氧化物的水化物一定是强酸
C. B、C的简单离子都能破坏水的电离平衡
D. 氢化物还原性:C >D
难度: 困难查看答案及解析
-
直接甲醇燃料电池以其供电量大、持续时间长而极具发展前景,其工作原理如右图。下列关于它的说法正确的是
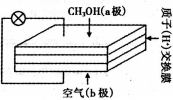
A. 电子自b极经外电路流向a极
B. b极的电极反应式为O2 +4e - +4H+= 2H2O
C. 质子交换膜中的H+流向a极
D. 用该电池电解CuSO4溶液,理论上每生成0.1 molCu消耗氧气1.12 L
难度: 中等查看答案及解析
-
25℃时,向10 mL mol·L-1H2A溶液中滴加等浓度的NaOH溶液,混合后溶液的pH与所加NaOH溶液的体积关系如图所示、下列叙述正确的是

A. NaHA的电离方程式为NaHA
Na++HA-
B. B点:c(H2A)+c(H+)=c(OH-)+c(A2-)
C. C点:c(Na+)= c(A2-)+c(HA -)
D. D点:c(Na+)>c(A2-)>c( HA -)>c(OH-)>c(H+)
难度: 困难查看答案及解析

 2NH3(g) △H=-92.0kJ•mol-1,相关键能数据如下:
2NH3(g) △H=-92.0kJ•mol-1,相关键能数据如下: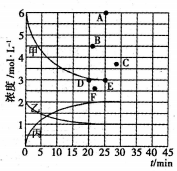



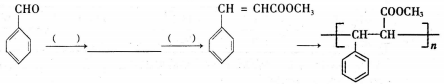
 )的单体是薰衣草的调和香料,以苯甲醛(
)的单体是薰衣草的调和香料,以苯甲醛( )为起始原料(其余有机、无机原料任选),参照G的合成,设计并补充完成下列合成路线图:__________(空格内有几步,写几步。)
)为起始原料(其余有机、无机原料任选),参照G的合成,设计并补充完成下列合成路线图:__________(空格内有几步,写几步。)