-
为研究哈伯法合成氨反应,T℃时,在容积为2 L恒容容器中通入4 mol N2和12mol H2,反应如下: N2(g)+3H2(g)  2NH3(g) △H=-92.0kJ•mol-1,相关键能数据如下:
2NH3(g) △H=-92.0kJ•mol-1,相关键能数据如下:
| N≡N | H-H | N-H |
| 键能数据( kJ/mol) | 946 | 436 | X |
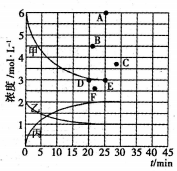
若25min时反应达到平衡,各物质浓度随时间变化曲线如下图中甲、乙、丙。回答下列问题:
(1)0-25min内,反应的平均速率v(H2)为_________;表中X=_________________。
(2)T℃时,该反应的平衡常数K=_____________ (用最简分数表达)。
(3)T℃时,若起始充入8mol N2和24 mol H2,则反应刚达到平衡时,表示c( H2)在右图中相应的点为_____(填字母)。
(4)以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
①C(s) +H2O(g) CO(g) +H2(g) △H1
CO(g) +H2(g) △H1
②CO(g) +H2O(g) CO2(g) +H2(g) △H2
CO2(g) +H2(g) △H2
若已知CO和H2的燃烧热分别为283 kJ·mol-l和285.8kJ·mol-l;H2O( g) =H2O(1) △H =-44kJ·mol-l 则△H2=_______________。
(5)氨气是生产硝酸的重要原料,其过程如下:
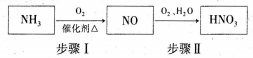
写出步骤I的化学方程式:_________________。
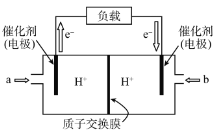
(6)下图是科学家提出的利用电解法常温常压下由氮气、氢气合成氨的示意图:
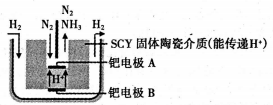
由图可知,钯电极B是电解池的________(填“阴极”或“阳极”);钯电极A上的电极反应式为________。
-
哈伯法合成氨技术的相关反应为:N2(g)+3H2(g)  2NH3(g) △H=-93kJ/mol
2NH3(g) △H=-93kJ/mol
(1)试根据表中所列键能数据计算a的数值为_____________。

(2)在600℃下,向2L密闭容器中充入一定量的反应物并开始上述反应,图表示N2的物质的量随时间的变化曲线。
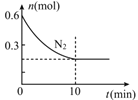
用H2表示0~10min内该反应的平均速率v(H2)= _____________,若该温度下K=0.0016L2/mol2,则在10min时c(H2)= _____________。
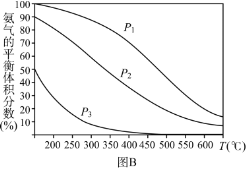
(3)在哈伯合成法中,平衡时NH3的体积分数与反应体系的压强(P)、温度(T)的关系如图B。则P1_____________P2(选填¨大于”、“小于”或¨不能确定”),其他条件相同,不同压强下在刚开始反应时反应物活化分子浓度较大的是_____________(选填“P1”、“P2”、“P3”或“不能确定”),在日本的合成氨工业中,选择合成温度为700℃的较高温,试从化学动力学的角度分析其理由是_____________。
(4)研究表明,合成氨的速率与相关物质的浓度的关系为v=kc(N2)c(H2)3/2c(NH3)-1,k为速率常数。能使合成氨的速率增大的措施是_____________。
A.使用更有效的催化剂
B.总压强一定,增大n(N2 )/n(H2)的值
C.升高反应温度
D.按照原来比值增大反应物的浓度
E.将原容器中NH3及时分离出来
(5)如图是利用NH3催化氧化释放出电能的电池结构示意图(氧化产物为无污染性气体),放电时O2应从_____________(填“a”或“b”)处通入,该电池负极的电极反应式为_____________。
-
(12分)在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g)△H<0,反应中NH3的浓度变化如下图:
2NH3(g)△H<0,反应中NH3的浓度变化如下图:
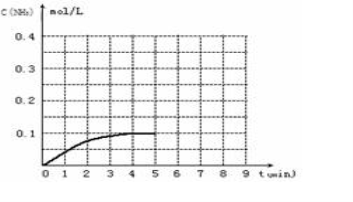
(1)根据上图,4min~5min之间,反应处于_________状态;(填“平衡”或“非平衡”)。
计算0~4min内,平均反应速率υ(NH3)= 。
(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,反应达到新平衡后,则NH3的物质的量浓度不可能为 。
A.0.2mol·L-1 B.0.12mol·L-1 C.0.10mol·L-1 D.0.08mol·L-1
(3)反应达到平衡后,第5分钟末,保持其它条件不变,把容器的体积缩小为原来的一半,则平衡________________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数________(填“增大”、“减小”或“不变”)。
(4)在第5分钟末,将容器体积缩小为原来的一半后,若在第8分钟末达到新的平衡时(此时NH3的浓度约为0.25mol·L-1)。请在上图中画出第5分钟末到平衡时NH3浓度的变化曲线。
-
氨的合成对社会发展与进步有巨大贡献。
(1)某温度下,在容积均为2L的两个密闭容器中分别发生反应。N2(g)+3H2(g)  2NH3(g) △H=-92.0kJ/mol。相关数据如下:
2NH3(g) △H=-92.0kJ/mol。相关数据如下:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molN2(g)和3molH2(g) | 2molNH3(g) |
| 平衡时c(NH3) | c1 | c2 |
| 平衡时能量变化 | 放出18.4kJ | 吸收akJ |
①下列情况能说明该反应一定达到中平衡状态的是_____(填字母)。
A.3v(N2)正=v(H2)逆 B.N2、H2的浓度之比不再随时间改变
C.容器内混合气体的密度保持不变 D.容器内混合气体的平均相对分子质量不变
②其他条件不变,达到平衡后,下列不能提高H2转化率的操作是_____ (填字母)。
A.升高温度 B.充入更多的H2 C.移除NH3 D.压缩容器体积
③c1__c2(填“>”“<”或“=”)。
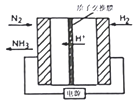
(2)合成氨也可以采用电化学法,其原理如右图所示。则阴极的电极反应式是_________。
(3)已知:氨在某催化剂催化氧化过程中主要有以下两个竞争反应:
反应I:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-906kJ/mol
4NO(g)+6H2O(g) △H=-906kJ/mol
反应II:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H=-1267kJ/mol
2N2(g)+6H2O(g) △H=-1267kJ/mol
①该条件下,N2(g)+O2(g) 2NO(g) △H=_____kJ/mol
2NO(g) △H=_____kJ/mol
②为分析催化剂对反应的选择性,在1L密闭容器中充入1molNH3和2molO2,在一定时间内测得有关物质的物质的量随温度变化如图所示。
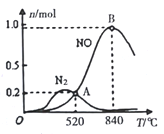
该催化剂在较低温度时主要选择___填“反应I”或“反应II”)。当温度高于840℃时,反应I中NO的物质的量减少的原因是________。520℃时,反应I的平衡常数K=____(只列算式不计算)。
-
已知合成氨的反应为:N2(g)+3H2(g) 2NH3(g);△H=-QkJ·mo(Q>0)。
2NH3(g);△H=-QkJ·mo(Q>0)。
在同温同压下向密闭容器甲中通入lmolN2和3molH2,达平衡时,放出的热量为QlkJ;
向另一容积相同的密闭容器乙中通入0.5molN2和1.5 molH2,反应达平衡时,放出的热量为Q2kJ。则下列关系式正确的是
A.2Q2<Ql<Q B.2Q2=Q1<Q C.2Q2=Q1=Q D.Ql<Q2<Q
-
在合成氨工业和硝酸制备工业中,常产生N2O、NO和NO2等氮氧化物造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)在2L密闭容器中通入3mol H2和1mol N2,测得不同温度下,NH3的产率随时间的变化如图所示。

①下列有关说法正确的是________(填序号)。
A.a处的v正>0
B.e点的v净=0
C.由b点到c点混合气体相对分子质量逐渐增大
D.平衡时,通入氩气平衡正向移动
②T2温度时,0~5min内v(N2)=___mol·L-1·min-l
③已知:瞬时速率表达式v正=k正c3(H2)∙c(N2),v逆=k逆c2(NH3)(k为速率常数,只与温度有关)。温度由T1调到T2,活化分子百分率________。(填“增大”“减小”或“不变”),
k正增大倍数____k逆增大倍数(填“大于”“小于”或“等于”)。T1°C时, ____
____
(2)工业生产尾气中产生的N2O需进行分解处理,用碘蒸气可大大提高N2O的分解速率,反应历程如下:
第一步:I2(g)=2I(g) (快反应)
第二步:I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步: IO(g)+N2O(g)→N2(g)+O2(g)+I(g) ( 快反应)
在反应过程中,I2的浓度与N2O分解速率_____ (填“有关”或“无关”);第___步反应对总反应速率起决定性作用;第二步的活化能比第三步____(填 “大”“小”或“相等”)。
(3)已除去N2O的硝酸尾气NO和NO2可用NaOH溶液吸收,写出NO和NO2与NaOH反应生成一种盐的反应方程式:_______;已知,常温下HNO2的电离常数Ka=5×10-4,则0.5mol/L对应钠盐的pH值为_______
-
氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.
(1)传统哈伯法合成氨工艺中相关的反应式为:N2+3H2 2NH3 △H<0.
2NH3 △H<0.
①该反应的平衡常数K的表达式为:K=______.升高温度,K值______(填“增大”“减小”或“不变”).
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3).分析表中数据,______(填温度和压强)时H2转化率最高,实际工业生产不选用该条件的主要原因是______.
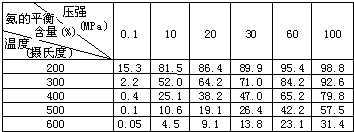
③下列关于合成氨说法正确是______(填字母)
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于△H<0、△S>0,故合成氨反应一定能自发进行
D.增大n(N2):n(H2)的比值,有利于提高H2的转化率
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法.它既有液氢燃料电池的优点,又克服了液氢不易保存的不足.其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应为
4NH3+3O2=2N2+6H2O
你认为电解质溶液应显______ 性(填“酸性”、“中性“、“碱性”),写出负极电极反应式______.
-
氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.
(1)传统哈伯法合成氨工艺中相关的反应式为:N2+3H2 2NH3 △H<0.
2NH3 △H<0.
①该反应的平衡常数K的表达式为:K=______.升高温度,K值______(填“增大”“减小”或“不变”).
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3).分析表中数据,______(填温度和压强)时H2转化率最高,实际工业生产不选用该条件的主要原因是______.

③下列关于合成氨说法正确是______(填字母)
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于△H<0、△S>0,故合成氨反应一定能自发进行
D.增大n(N2):n(H2)的比值,有利于提高H2的转化率
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法.它既有液氢燃料电池的优点,又克服了液氢不易保存的不足.其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应为
4NH3+3O2=2N2+6H2O
你认为电解质溶液应显______ 性(填“酸性”、“中性“、“碱性”),写出负极电极反应式______.
-
容积均为2L的甲乙丙三个恒容密闭容器中均加入0.10mol/L的N2、0.26mol/L的H2,进行合成氨反应:N2(g)+3H2(g)  2NH3(g) △H=-92.4kJ/mol。图1表示不同反应条件下N2的浓度随时间的变化,图2表示其它条件相同,温度分别为T1、T2、T3且恒定不变,达到平衡时NH3的质量分数。
2NH3(g) △H=-92.4kJ/mol。图1表示不同反应条件下N2的浓度随时间的变化,图2表示其它条件相同,温度分别为T1、T2、T3且恒定不变,达到平衡时NH3的质量分数。

下列判断不正确的是
A. 图2 中反应速率最快的是容器丙
B. 图1 中容器乙的反应可能使用了催化剂
C. 图l 中容器乙0~5 min时间内v(N2) = 0.012mol/(L·min)
D. 图1 中容器丙内反应的平衡常数为2.5
-
合成氯是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g)  2NH3(g) ΔH=-93.0kJ/mol
2NH3(g) ΔH=-93.0kJ/mol
(1)某温度下,在2 L密闭容器中发生上述反应,测得数据如下
| 时间/h 物质的量/mol | 0 | 1 | 2 | 3 | 4 |
| N2 | 2.0 | 1.83 | 1.7 | 1.6 | 1.6 |
| H2 | 6.0 | 5.49 | 5.1 | 4.8 | 4.8 |
| NH3 | 0 | 0.34 | 0.6 | 0.8 | 0.8 |
①0~2 h内,v(N2)= 。
②平衡时,H2的转化率为____;该温度下,反应2NH3(g)  N2(g)+3H2(g)的平衡常数K= 。
N2(g)+3H2(g)的平衡常数K= 。
③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3比的浓度与上表中相同的为 (填选项字母)。
A.a=l、b=3.c=0 B.a=4、b=12、c=0
C.a=0、b=0.c=4 D.a=l、b=3、c=2
(2)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热ΔH=-286kJ/mol,则陪制NH3反应的热化学方程式为 。
(3)采用高质子导电性的SCY陶瓷(能传递H'),通过电解法也可合成氨,原理为:
N2(g)+3H2(g)  2NH3(g)。在电解法合成氨的过程申,应将N2不断地通入 ___极,该电极反应式为 。
2NH3(g)。在电解法合成氨的过程申,应将N2不断地通入 ___极,该电极反应式为 。
 2NH3(g) △H=-92.0kJ•mol-1,相关键能数据如下:
2NH3(g) △H=-92.0kJ•mol-1,相关键能数据如下:
CO(g) +H2(g) △H1
CO2(g) +H2(g) △H2












