-
下列变化中不属于化学变化的是
A.工业上用石灰石生产生石灰 B.工业上用空气生产氧气
C.工业上用玉米、高粱等生产酒精 D.工业上把生铁炼成钢
难度: 简单查看答案及解析
-
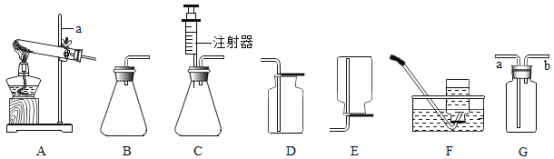
下列图示实验操作中,正确的是
A.
B.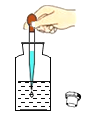
C.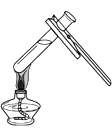
D.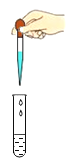
难度: 简单查看答案及解析
-
下列说法正确的是
A.镁条在空气中燃烧生成黑色固体 B.一氧化碳在空气中燃烧发出蓝色火焰
C.红磷在空气中燃烧产生大量白雾 D.木炭伸入盛有氧气的集气瓶中剧烈燃烧
难度: 简单查看答案及解析
-
下列物质的用途主要不是由化学性质决定的是
A.氮气用作保护气 B.水可用于灭火
C.一氧化碳作燃料 D.氧气用于炼钢
难度: 简单查看答案及解析
-
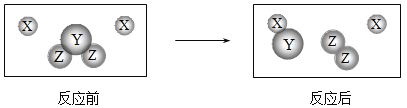
如图表示两种物质发生的化学反应,其中相同的球代表同种原子,小球间的短线代表原子间的结合.下列说法中不正确的是
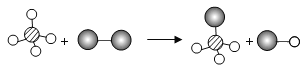
A.图示有4种分子 B.图示反应前后原子个数不变
C.图示发生了置换反应 D.图示产物为混合物
难度: 中等查看答案及解析
-
党的十九大报告指出,建设美丽中国,为人民创造良好生产生活环境,为全球生态安全作出贡献,并强调:“必须树立和践行绿水青山就是金山银山的理念。”下列做法不符合这一理念的是
A.大量植树造林,禁止乱砍滥伐 B.推广取暖“煤改电”,大力发展火力发电
C.改造或淘汰高能耗、高污染产业 D.在建筑中增强自然采光,减少照明用电
难度: 简单查看答案及解析
-
核电站中核燃料铀或钚在中子的撞击下,原子核发生分裂,产生氙、锶等原子及一些粒子和射线,同时释放大量的能量,这些能量可用于驱动汽轮机发电.锶元素在元素周期表中显示的信息和粒子结构示意图如图所示.以下表述中正确的是( )
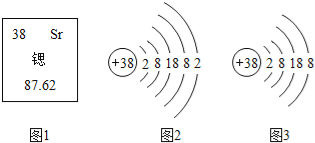
A. 图2、图3都属于锶元素 B. 图3所表示粒子的化学符号是Sr
C. 锶原子的中子数为38 D. 锶原子的相对原子质量是87.62g
难度: 简单查看答案及解析
-
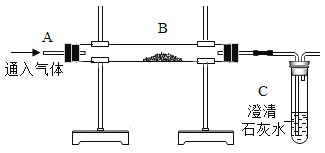
A.固体中氧元素的质量 B.生成的氧气质量
C.固体中的二氧化锰质量 D.固体中钾元素的质量分数
难度: 简单查看答案及解析
-
我国“辽宁号”航母甲板上涂有耐高温、耐磨的碳化硅(SiC)涂层,碳化硅的结构类似于金刚石的结构,则构成碳化硅的粒子是
A.分子 B.原子 C.离子 D.中子
难度: 简单查看答案及解析
-
下列物质中属于纯净物的是
A.天然气 B.水银 C.不锈钢 D.碘酒
难度: 简单查看答案及解析
-
微粒是构成化学物质的基础,下列对微粒的描述正确的是
A.仅由碳原子构成的物质属于单质
B.原子中一定含有质子、中子、电子
C.NaCl是由离子构成的,所以HCl也是由离子构成的
D.科学家成功制备出了一种含铱元素(Ir)的阳离子,在这种离子中,铱元素显+9价,则该离子符号为IrO4+
难度: 中等查看答案及解析
-
下列事故的处理方法错误的是
A.炒菜时,油锅着火,立即放入较多蔬菜
B.图书室内文字资料起火,立即用泡沫灭火器灭火
C.发生一氧化碳中毒,立即转移到通风的地方救治
D.实验桌上少量酒精着火,立即用湿布盖灭
难度: 简单查看答案及解析
-
生活之中处处有化学。下列说法正确的是
A.自来水净化中加入明矾杀菌消毒 B.用纯铜片在黄铜片上刻划出明显的痕迹
C.用天然气替代煤减少酸雨的形成 D.洗油污加入洗涤剂以便形成稳定的溶液
难度: 中等查看答案及解析
-
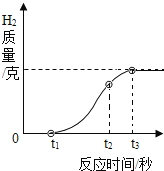
下图是反映某个化学反应里个物质质量与时间的变化关系,下列对此变化的描述中,正确的是
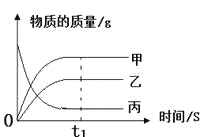
A.充分反应后,乙+丙=甲的质量
B.物质甲的相对分子质量大于乙
C.此化学反应中,不遵守质量守恒定律
D.反应了此化学反应是分解反应
难度: 困难查看答案及解析
-
根据生活经验和所学知识判断,下列课外实验不能成功的是
A.用活性炭使海水转化为淡水 B.用肥皂水鉴别硬水和软水
C.用食醋除去暖水瓶中的水垢 D.用二氧化碳作温室大棚内蔬菜的肥料
难度: 简单查看答案及解析
-
钛合金是生产链条钢、锚链钢等的重要原料。如果要比较钛(Ti)和铁的金属活动顺序,以下方法不能达到目的的是
A.查阅初中化学课本上的金属活动顺序表
B.利用金属钛和FeCl2溶液进行实验
C.利用金属铁和TiSO4溶液进行实验
D.利用金属钛、金属铁与稀硫酸进行实验
难度: 简单查看答案及解析
-
通过下列实验操作和现象能得出相应结论的是
实验操作
现象
结论
A
向收集满 CO2的软塑料瓶中加入约1/3 体积滴有石蕊试液的水,旋紧瓶盖,振荡
塑料瓶变瘪,
溶液变红
CO2能与石蕊反应
B
用课本中的装置做测定空气中氧气含量的实验
进入瓶中的水量超过了瓶内空气体积的1/5
所用的燃烧物可能是硫粉
C
将白磷浸没在热水中,再向热水中的白磷通氧气
通氧气前白磷不燃烧,通氧气后白磷燃烧
氧气是可燃物燃烧的条件之一
D
把质量相同的镁条与锌粒同时放入相同浓度和体积的盐酸屮
镁条与盐酸
产生气体更快
镁的金属活动性比锌强
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入m克Zn,充分反应后过滤,将滤渣洗涤、干燥后再称量,得到的质量为m克。据此,下列说法不正确的是
A.取反应后的滤液观察,滤液可能呈蓝色
B.取反应后的滤液插入铜丝,有银白色固体产生
C.取滤渣滴加稀硫酸,可能有气泡产生
D.滤渣中的物质至少有两种
难度: 困难查看答案及解析
-
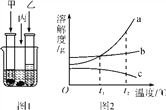
A、B、C三种物质的溶解度曲线如图5所示。下列分析正确的是
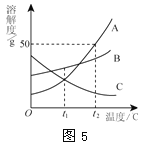
A.t1℃时,A、C两种物质的饱和溶液中溶质的质量相等
B.t2℃时,把50gA放入50g水中能得到A的饱和溶液,其中溶质和溶液的质量比为1∶3
C.将t2℃时,A、B、C三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数的大小关系是B>C=A
D.将C的饱和溶液变为不饱和溶液,可采用升温的方法
难度: 中等查看答案及解析