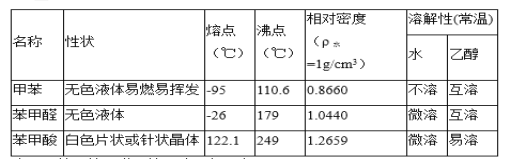
-
化学与生产、生活及环境密切相关,下列有关说法不正确的是( )
A.餐具上的油污可用热的纯碱溶液清洗,纺织品上的油污不可以用烧碱溶液清洗
B.工业生产时加入适宜的催化剂,除了可以加快反应速率之外,还可以降低反应所需的温度,从而减少能耗
C.一定条件下,1mol 化合物X(
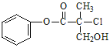 )最多可以与2molNaOH反应
)最多可以与2molNaOH反应D.用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜目的
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.乙二醇通过消去反应可制得
B.化合物
的所有原子可能处在同一平面上
C.按系统命名法,化合物
的名称是2,2-二甲基-5-乙基己烷
D.甲醛与氨气制备乌洛托品(
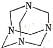 )的最佳配比:n(NH3):n(HCHO)=2:3
)的最佳配比:n(NH3):n(HCHO)=2:3难度: 中等查看答案及解析
-
下列事实中,不能用勒夏特列原理解释的是
①Fe(SCN)3溶液中加入固体KSCN后颜色变深②向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 ③实验室常用排饱和食盐水的方法收集氯气 ④棕红色NO2加压后颜色先变深后变浅 ⑤加入催化剂有利于合成氨的反应 ⑥由H2(g)、I2(g)和HI(g)组成的平衡体系加压后颜色变深 ⑦500℃时比室温更有利于合成氨的反应 ⑧将混合气体中的氨液化有利于合成氨反应
A. ①②⑥⑧ B. ①③⑤⑦ C. ②⑤⑥⑦ D. ②③⑦⑧
难度: 简单查看答案及解析
-
下列有关热化学方程式的叙述,正确的是( )
A.反应物的总能量低于生成物的总能量时,该反应必须加热才能发生
B.由N2O4(g)⇌2NO2(g) ΔH=+56.9kJ·mol-1,可知将1molN2O4(g)置于密闭容器中充分反应后吸收的热量为56.9kJ
C.由:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1,可知含1molHCN的稀溶液与含1molNaOH的稀溶液混合,放出热量为57.3kJ
D.已知101kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1,则1mol碳完全燃烧放出的热量大于110.5kJ
难度: 中等查看答案及解析
-
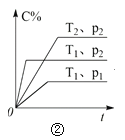
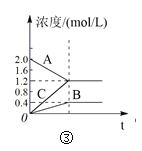
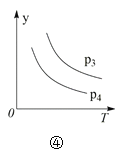
下列叙述与下图对应的是( )
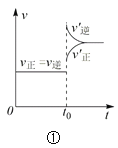
A.对于达到平衡状态的N2(g) + 3H2(g) ⇌ 2NH3(g),图①表示在t0时刻充入了一定量的NH3,平衡逆向移动
B.由图②可知,p2 > p1,T1 > T2满足反应:2A(g) + B(g) ⇌ 2C(g) ΔH < 0
C.图③表示的反应方程式为2A = B + 3C
D.对于反应2X(g) + 3Y(g) ⇌ 2Z(g) ΔH < 0,图④y轴可以表示Y的百分含量
难度: 简单查看答案及解析
-
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图所示(未表示出原子或原子团的空间排列)。该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是
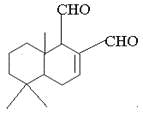
A.Br2的CCl4溶液
B.Ag(NH3)2OH溶液
C.HBr
D.H2
难度: 中等查看答案及解析
-
中国女药学家屠呦呦从植物黄花蒿茎叶中提取的青蒿素,荣获2015年诺贝尔奖。下列有关青蒿素的叙述不正确的是( )
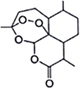
A.分子式为C15H22O5
B.它在乙醚中的溶解度大于在水中的溶解度
C.能发生取代反应、水解反应、加成反应,不能发生氧化反应
D.该物质不稳定,容易受到热和还原性物质的影响而发生变质
难度: 中等查看答案及解析
-
饱和一元醇35.2g和足量的金属Na反应,生成标准状况下氢气为4.48L,该醇可氧化成醛,则其结构可能有几种( )
A.2种 B.3种 C.4种 D.5种
难度: 中等查看答案及解析
-
已知:
CH3CH2CH2+HCl
CH3CH2CH3 +Cl
CH(CH3)2 + HCl
CH3CH2CH2+ HBr
CH3CH2CH3+Br
CH(CH3)2+HBr
下列说法正确的是( )
A.ΔH1=ΔH2+ΔH3-ΔH4
B.HCl和HBr的键能差可以表示为ΔH1-ΔH3
C.ΔH2>ΔH4
D.升温时,丙烷与Cl反应速率加快,与Br反应速率降低
难度: 中等查看答案及解析
-
对于反应2SiHCl3(g)
SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法不正确的是( )
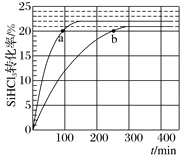
A.该反应的△H>0
B.a、b处反应速率大小关系:va大于vb
C.在343 K下,要提高SiHCl3转化率,可以及时移去产物或提高反应物浓度
D.343 K时,SiHCl3的平衡转化率为22%,可以求得该温度下的平衡常数约为0.02
难度: 中等查看答案及解析
-
常温下,下列关于NaOH溶液和氨水的说法正确的是( )
A.25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为20:1
B.pH=13的两溶液稀释100倍,pH都为11
C.两溶液中分别加入少量NH4Cl固体,c(OH −)均减小
D.体积相同、pH相同的两溶液能中和等物质的量的盐酸
难度: 中等查看答案及解析
-
双酚A(
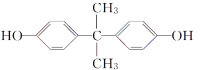 )是一种重要的化工原料,它的一种合成路线如下图所示:
)是一种重要的化工原料,它的一种合成路线如下图所示:丙烯
双酚A
下列说法正确的是( )
A.1 mol 双酚A最多可与2 mol Br2反应
B.G物质是乙醛的同系物
C.E物质的名称是1-溴丙烷
D.反应③的化学方程式是
+O2
2CH3COCH3+2H2O
难度: 中等查看答案及解析
-
已知:CO2(g)+2NaOH(aq)=Na2CO3(aq)+H2O(l) △H=Q1 kJ·mol-1;CO2(g)+NaOH(aq)=NaHCO3(aq) △H=Q2 kJ·mol-1。将15.68 L(标准状况)CO2气体通入1 L 1.0 mol·L-1氢氧化钠溶液中,反应完全时能量变化为Q3 kJ则Q1、Q2、Q3之间的关系正确的是( )
A.Q3=0.3 Q1+0.4Q2 B.Q3=0.7Q1 C.Q3=0.7Q2 D.Q3=0.4Q1+0.3Q2
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是

A. 图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B. 图乙表示向CH3COOH溶液中加水时溶液的导电性变化,且CH3COOH溶液的pH:a>b
C. 图丙表示加入催化剂,化学反应的焓变减小
D. 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的∆H<0
难度: 中等查看答案及解析
-
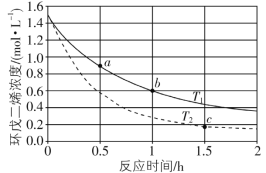
在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
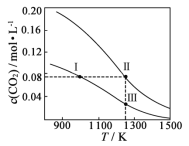
A.反应CO2(g)+C(s)
2CO(g)的ΔS>0、ΔH<0
B.体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D.逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ)
难度: 中等查看答案及解析
-
将E和F加入密闭容器中,在一定条件下发生反应:E(g) + F(s)
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
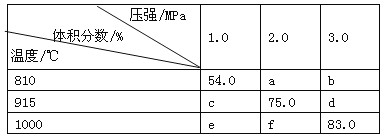
①b<f
②915 ℃、2.0 MPa时E的转化率为60%
③该反应的ΔS>0
④K(1 000 ℃)>K(810 ℃)
上述①~④中正确的有( )
A.4个 B.3个 C.2个 D.1个
难度: 困难查看答案及解析
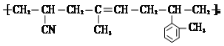 ,写出其合成单体除丙烯氰(CH2=CHCN),2-甲基苯乙烯外,还需要的单体名称是:__________。
,写出其合成单体除丙烯氰(CH2=CHCN),2-甲基苯乙烯外,还需要的单体名称是:__________。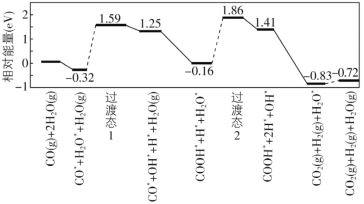
 (R表示烃基,R1、R2表示烃基或氢原子)。设计以
(R表示烃基,R1、R2表示烃基或氢原子)。设计以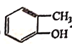 为原料制备
为原料制备
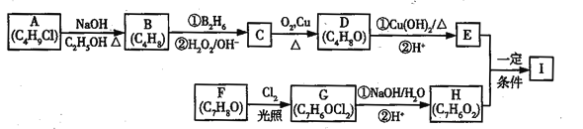
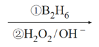 R﹣CH2CH2OH;
R﹣CH2CH2OH;