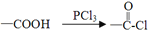-
为了除去MnSO4酸性溶液中的Fe3+,可加入过量的某种试剂充分搅拌,过滤。该试剂是
A. MnCO3 B. MnO2 C. Na2CO3 D. 氨水
难度: 中等查看答案及解析
-
分子式为C5H10O2能发生水解反应的有机物有(不含立体异构)
A. 6种 B. 7种 C. 8种 D. 9种
难度: 中等查看答案及解析
-
化学与生产、生活密切相关,下列说法错误的是
A. 液化石油气主要含乙烯、丙烯和甲烷
B. 限制氟利昂的使用是为了保护大气臭氧层
C. 在船身适当位置装锌块可以避免船体遭受腐蚀
D. 工业上冶炼像钠、钙、镁、铝这样的活泼金属,需采用电解法
难度: 简单查看答案及解析
-
25℃时,下列溶液等体积混合后,溶液pH>7的是
A. pH=3的H2SO4和pH=11的氨水
B. 0.1 mol/L的盐酸和0.2 mol/L的醋酸钠溶液
C. 等物质的量浓度的盐酸和氨水
D. 等物质的量浓度的硫酸和NaOH溶液
难度: 中等查看答案及解析
-
以下现象与电化腐蚀无关的是
A. 黄铜(铜锌合金)制作的铜锣不易产生铜绿
B. 生铁比软铁芯(几乎是纯铁)容易生锈
C. 铁质器件附有铜质配件,在接触处易生铁锈
D. 银质奖牌久置后表面变暗
难度: 简单查看答案及解析
-
化学与生活密切相关。下列说法正确的是
A.花生油、牛油都属于酯类
B.丝绸、棉都属于蛋白质
C.甘油、葡萄糖都属于糖类
D.氯乙烯、合成橡胶都属于有机高分子材料
难度: 简单查看答案及解析
-
以下现象中,不属于蛋白质变性的是
A.用波尔多液杀菌
B.用体积分数为75%的酒精消毒
C.鸡蛋白溶液中加入少量NaCl变浑浊
D.用氯化汞溶液消毒医疗器械
难度: 简单查看答案及解析
-
下列化学式中只能表示一种物质的是( )
A.C3H7Cl B.CH2Cl2 C.C2H6O D.C2H4O2
难度: 简单查看答案及解析
-
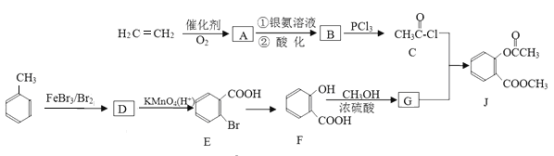
有机物J是一种广谱高效食品防腐剂,球棍模型如图所示:
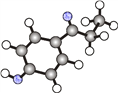 。该有机物分子中肯定不存在
。该有机物分子中肯定不存在A. 酚羟基 B. 甲基 C. 羰基 D. 醛基
难度: 简单查看答案及解析
-
在四只烧杯中分别注入下列物质的稀溶液,用惰性电极电解一段时间后,烧杯中溶液pH减小的是
A. MgCl2 B. Na2SO4 C. Na2CO3 D. AgNO3
难度: 简单查看答案及解析
-
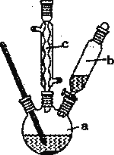
下列装置能达到实验目的的是
A. 观察铁的吸氧腐蚀
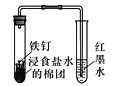 B. 实验室制乙烯
B. 实验室制乙烯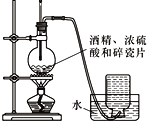 C. 检验乙炔的还原性
C. 检验乙炔的还原性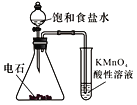 D. 实验室制乙酸乙酯
D. 实验室制乙酸乙酯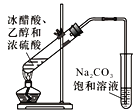
难度: 中等查看答案及解析
-
下表中除杂质所用试剂及方法错误的是
选项
物质(杂质)
除杂质所用试剂及方法
A
乙醇(水)
加入生石灰蒸馏
B
苯(苯酚)
加入浓溴水振荡后过滤
C
溴乙烷(溴单质)
加入NaHSO3溶液振荡、静置、分液
D
甲烷(乙烯)
依次通过KMnO4酸性溶液、NaOH溶液洗气
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
松油醇具有紫丁香味,其酯类常用于香精调制。松油醇的结构见下图,下列有关松油醇的说法错误的是
A. 分子式为C10H18O
B. 分子中有5个碳原子位于同一平面上
C. 发生消去反应的有机产物只有一种
D. 既能使Br2的CCl4溶液褪色,又能使酸性KMnO4溶液褪色
难度: 中等查看答案及解析
-
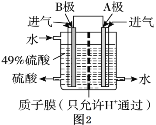
通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是
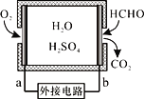
A. a为电池的正极,发生还原反应
B. b极的电极反应为HCHO+H2O-4e-==CO2+4H+
C. 传感器工作过程中,电解质溶液中硫酸的浓度减小
D. 当电路中转移2×10-4 mol电子时,传感器内参加反应的HCHO为3.0 mg
难度: 中等查看答案及解析
-
下列关于铜电极的叙述中,不正确的是
A.铜锌原电池中铜作正极
B.氯碱工业中用铜作阳极
C.用电解法精炼铜时粗铜作阳极
D.在镀件上镀铜时用金属铜作阳极
难度: 简单查看答案及解析
-
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:
Cd+2NiOOH+2H2O
Cd(OH)2+2Ni(OH)2由此可知,该电池充电时在阳极上发生反应的是( )
A.Ni(OH)2 B.Cd(OH)2 C.Cd D.NiOOH
难度: 简单查看答案及解析
-
已知A、B、C、D、E是原子序数依次增大的短周期主族元素,其中A、E的单质在常温下呈气态,B的最外层电子数是其电子层数的2倍,C在短周期主族元素中原子半径最大,D的合金是日常生活中常用的金属材料。下列说法正确的是
A.元素A、B组成的化合物常温下一定呈气态 B.元素C、D的最高价氧化物对应的水化物不能反应
C.工业上常用电解法制备元素C、D、E的单质 D.化合物AE与CE有相同类型的化学键
难度: 简单查看答案及解析
-
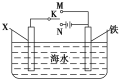
一种新型镁储备电池的储存寿命长,电压平稳,电池的总反应为Mg+Cu2Cl2=2Cu+MgCl2,以该电池为电源在铜片上镀银的实验装置如图所示。

下列说法正确的是
A.接通电路后,电池的正极质量减小
B.若反应消耗1mol Mg,则有1mol Cl-通过阴离子交换膜
C.M电极材料为铜片
D.接通电路后,AgNO3溶液的浓度减小
难度: 中等查看答案及解析
-
一定量的锌粉和6mol、L的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是( )
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸
A. ①②④ B. ①③⑤ C. ③④⑤ D. ①③④
难度: 中等查看答案及解析
-
如图是2004年批量生产的笔记本电脑所用甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH30H+302=2C02+4H20。下列说法正确的是
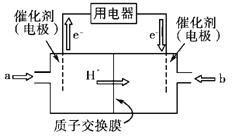
A.左电极为电池的正极,a处通入的物质是甲醇
B.右电极为电池的负极,b处通入的物质是空气
C.负极反应式为:CH30H+H20-6e-=CO2+6H+
D.正极反应式为:02+2H20+4e-=40H—
难度: 中等查看答案及解析
-
水溶解中能大量共存的一组离子是
A.Na+、Al3+、Cl-、CO32- B.H+、Na+、Fe2+、MnO4-
C.K+、Ca2+、Cl-、NO3- D.K+、NH4+、OH-、SO42-
难度: 简单查看答案及解析
-
常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(稀溶液混合时体积可直接相加)。下列判断错误的是
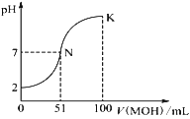
A. 由图中信息可知,HA一定是强酸
B. 当V(MOH)=50.00 mL时,混合溶液中c(M+)+c(MOH)=0.01 mol·L-1
C. N点对应的溶液中c(M+)=c(A-)
D. K点所对应的溶液中离子浓度大小关系为:c(M+)>c(A-)>c(OH-)>c(H+)
难度: 困难查看答案及解析
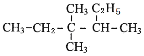 ___________________________________________
___________________________________________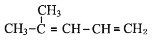 ___________________________
___________________________