-
在2008年春节期间,许多遭受雪灾的地区使用融雪盐除雪.下列有关说法不正确的是( )
A.融雪盐能使盐水混合物的凝固点降低
B.融雪盐只能使用氯化钠
C.过量使用融雪盐会加速钢铁桥梁的腐蚀
D.撒了融雪盐的积雪不宜往绿地、河流中倾倒难度: 中等查看答案及解析
-
最近媒体报道了一些化学物质,如:爆炸力极强的N5、结构类似白磷的N4、比黄金还贵的18O2、太空中的甲醇气团等.下列说法中,正确的是( )
A.18O2和16O2是两种不同的核素
B.将ag铜丝灼烧成黑色后趁热插入甲醇中,铜丝变红,质量小于a g
C.N4为正四面体结构,每个分子中含有6个共价键,键角为109°28'
D.2N5=5N2是化学变化难度: 中等查看答案及解析
-
下列说法正确的是( )
A.把100mL3mol•L-1的H2SO4跟100mLH2O混合,硫酸的物质的量浓度改变为1.5mol•L-1
B.把200mL3mol•L-1的BaCl2溶液跟100mL3mol•L-1的KCl溶液混合后,溶液中的C(Cl-)仍然是3mol•L-1
C.把100g20%的NaCl溶液跟100gH2O混合后,NaCl溶液的质量分数是10%
D.把100mL20%的NaOH溶液跟100mLH2O混合后,NaOH溶液的质量分数是10%难度: 中等查看答案及解析
-
设计学生试验要注意安全、无污染、现象明显.根据启普发生器原理,可用底部有小孔的试管制简易的气体发生器(如图).若关闭K,不能使反应停止,可将试管从烧杯中取出(会有部分气体逸出).下列气体的制取宜使用该装置的是( )
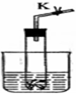
A.用二氧化锰(粉末)与双氧水制氧气
B.用碳酸钙(块状)与稀硫酸制二氧化碳
C.用硫化亚铁(块状)与盐酸制硫化氢
D.用锌粒与稀硫酸制氢气难度: 中等查看答案及解析
-
化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( )
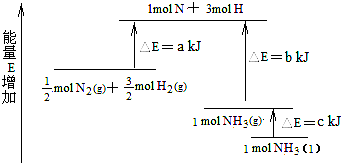
A.N2(g)+3H2(g)=2NH3(l);△H=2(a-b-c)kJ•mol-1
B.N2(g)+3H2(g)=2NH3(g);△H=2(b-a)kJ•mol-1
C.N2(g)+
H2(g)=NH3(l);△H=(b+c-a)kJ•mol-1
D.N2(g)+
H2(g)=NH3(g);△H=(a+b)kJ•mol-1
难度: 中等查看答案及解析
-
将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )
A.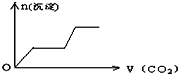
B.
C.
D.
难度: 中等查看答案及解析
-
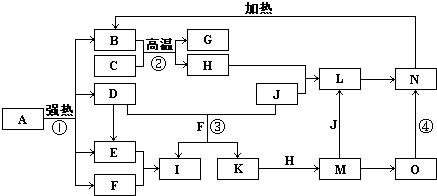
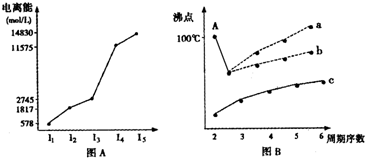
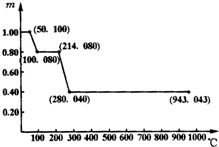
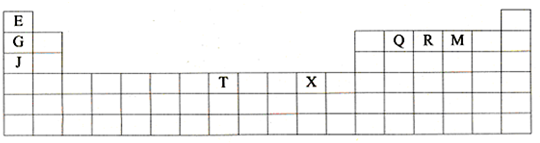
下列4组连线中,完全正确的一组是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO42-,若将2.83g X中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-和过量KI溶液反应又生成Cr3+,同时得到3.81gI2;若向溶有2.83gX的溶液中,加入过量的BaCl2溶液,可得到4.66g白色沉淀.由此可推断出X的化学式为( )
A.K2SO4•2Cr2(SO4)3
B.2K2SO4•Cr2(SO4)3
C.K2SO4•Cr2(SO4)3
D.K2SO4•Cr2(SO4)3
难度: 中等查看答案及解析
-
下列有关反应热的叙述正确的是( )
A.已知2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
B.C(s,石墨)=C(s,金刚石);△H=+1.9kJ•mol-1,说明金刚石比石墨稳定
C.X(g)+Y(g)⇌Z(g)+W(s);△H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
D.已知C(s)+O2(g)=CO2(g);△H1,C(s)+1/2O2(g)=CO(g);△H2,则△H1<△H2难度: 中等查看答案及解析
-
某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物测定生成气体的体积
方案Ⅱ:铜铝混合物测定剩余固体的质量
下列有关判断中不正确的是( )
A.溶液A和B均可以是盐酸或NaOH溶液
B.溶液A和B均可以选用稀硝酸
C.若溶液B选用浓硝酸,则测得铜的质量分数偏小
D.实验室方案Ⅱ更便于实施难度: 中等查看答案及解析
-
如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
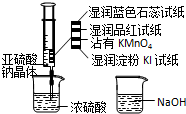
A.蓝色石蕊试纸先变红后褪色
B.NaOH溶液可用于除去实验中多余的SO2
C.湿润淀粉KI试纸未变蓝说明SO2的氧化性弱于I2
D.品红试纸、沾有KMnO4溶液滤纸均褪色都能证明SO2的漂白性难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.Fe3O4与稀硝酸反应:Fe3O4+8H+═Fe2++2Fe3++4H2O
B.向硝酸银溶液中逐滴滴入稀氨水直至过量:Ag++2NH3•H2O═[Ag(NH3)2]++2H2O
C.Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O
D.4 mol/L的KAl(SO4)2溶液与7 mol/L的Ba(OH)2溶液等体积混合:4Al3++7SO42-+7Ba2++14OH-═2Al(OH)3↓+2AlO2-+7BaSO4↓+4H2O难度: 中等查看答案及解析
-
一定条件下,碘单质与砹单质以等物质的量进行反应,可得AtI.它与Zn、NH3都能发生反应,化学方程式分别如下:
2AtI+2Zn═ZnI2+ZnAt2
AtI+2NH3(l)═NH4I+At NH2.
下列叙述正确的是( )
A.ZnI2既是氧化产物,又是还原产物
B.ZnAt2既是氧化产物,又是还原产物
C.AtI与液氨反应,AtI既是氧化剂,又是还原剂
D.AtI与液氨的反应中,得失电子数相等难度: 中等查看答案及解析
-
近年用红外激光技术研究液氢,发现范德华力也可以引起微粒间反应,已知在液氢中有氢分子和质子形成的
离子,其构型为等边三角型,属于二电子三中心离子.同时
和氢分子可进一步形成
.有关判断正确的是( )
A.的电子式为
B.可进行反应,在液态氢中形成
、
、
C.可在液态氢中形成
、
、
D.广泛存在于固态、液态和气态氢中
难度: 中等查看答案及解析