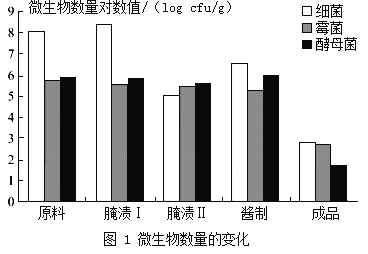
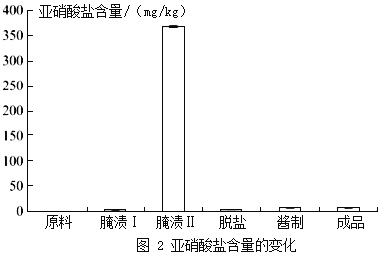
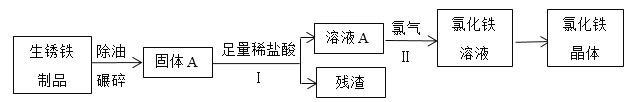
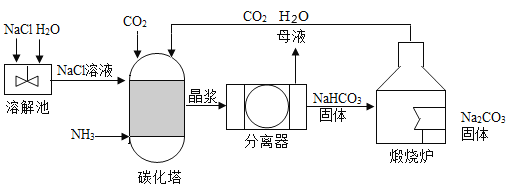
-
小刚测定了下列4种日用品的pH,其中呈酸性的是
日用品
A.洁厕灵
B.洗涤灵
C.洗发水
D.消毒液
pH
1
7
9
12
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
空气中含量最多的气体是( )
A.氧气 B.二氧化碳 C.稀有气体 D.氮气
难度: 简单查看答案及解析
-
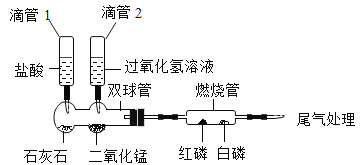
下列物质在氧气中燃烧,产生大量白烟的是
A.木炭 B.红磷 C.氢气 D.铁丝
难度: 简单查看答案及解析
-
我省明代科学家宋应星所著的《天工开物》中,详细记述了金、铜、铁、锌等金属的开采和冶炼方法,记述的金属中金属活动性最强的是( )
A.金
B.锌
C.铁
D.铜
难度: 简单查看答案及解析
-
下列实验操作中,正确的是( )
A.
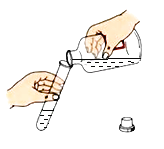 倾倒液体 B.
倾倒液体 B. 加热液体
加热液体C.
 向试管中加固体 D.
向试管中加固体 D. 加热固体
加热固体难度: 简单查看答案及解析
-
铟元素相关信息如图所示,下列说法正确的是( )
A.铟元素属于非金属元素
B.铟原子的中子数为49
C.铟原子的核外电子数为114
D.铟原子的相对原子质量为114.8
难度: 简单查看答案及解析
-
下列物质的化学式不正确的是( )
A.干冰:CO2 B.熟石灰:Ca(OH)2 C.纯碱:Na2CO3 D.烧碱:NaCl
难度: 简单查看答案及解析
-
下列关于物质用途的描述中,不正确的是( )
A.液氮用作制冷剂 B.大理石用于建筑材料
C.浓硫酸用作干燥剂 D.氢氧化钠用于治疗胃酸过多症
难度: 简单查看答案及解析
-
青蒿素(C15H22O5)是一种治疗疟疾的药物,我国女科学家屠呦呦因发现青蒿素荣获诺贝尔奖,下列说法正确的的是( )
A.每个青蒿素分子中含有42个原子
B.青蒿素中C、H、O三种元素的质量比是15:22:5
C.青蒿素的相对分子质量为282g
D.青蒿素中氢元素的质量分数最高
难度: 中等查看答案及解析
-
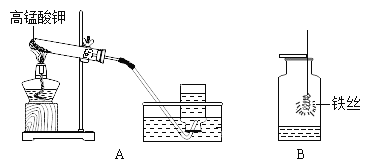
用如图所示装置测定空气中氧气的含量。加热粗铜丝一段时间后,白磷燃烧。下列说法不正确的是( )
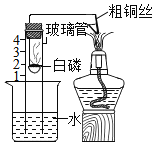
A.实验中白磷应过量
B.实验中玻璃管中液面先下降,后上升
C.用木炭代替白磷仍能达到实验目的
D.玻璃管内液面最终上升至刻度1处,证明了空气中氧气的含量
难度: 简单查看答案及解析
-
利用如下图所示步骤进行实验,其中不能达到实验目的的是( )
实验目的
实验步骤
A
比较铁、铜的金属活动性强弱
①加入铜粉末;②加入适量稀硫酸搅拌;③加入铁片
B
检验NaCl中混有Na2CO3
①加入少量样品;②加入适量水至全部溶解;
③加入适量稀盐酸
C
验证KCl不能无限溶解
20°C时,①加入100g水;②加入18gKCl搅拌;③加入16gKCl搅拌(已知:20℃时,KCl的溶解度为34g)
D
配置50g溶质质量分数为5%的氯化钠溶液
①加入2.5gNaCl;②加入47.5g水;③搅拌至全部溶解
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
科学家成功地将二氧化碳转化为乙烯,反应前后分子种类变化的微观示意图如下。下列说法不正确的是( )

A.乙烯的化学式为C2H4 B.甲和丁均为氧化物
C.生成丙和丁的分子个数比为1:1 D.参加反应的甲与乙的质量比为22:3
难度: 中等查看答案及解析