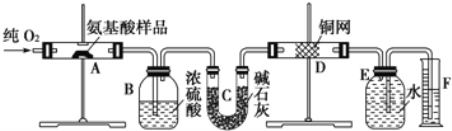
-
下列混合物的分离和提纯方法中,主要是从沸点的角度考虑的是( )
A. 分液 B. 蒸馏 C. 过滤 D. 萃取
难度: 简单查看答案及解析
-
电解稀H2SO4、Cu(NO3)2、NaCl的混合液,最初一段时间阴极和阳极上析出的物质分别是( )。
A.Cu和Cl2 B.H2和Cl2 C.H2和O2 D.Cu和O2
难度: 简单查看答案及解析
-
下列卤代烃发生消去后,可以得到两种烯烃的是
A.1-氯丁烷 B.氯乙烷
C.2-氯丁烷 D.2-甲基-2-溴丙烷
难度: 简单查看答案及解析
-
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是
A.Mg2++ 2HCO3-+ 2Ca2++ 4OH-= Mg(OH)2↓+ 2CaCO3↓+ 2H2O
B.Cu2++ H2S = CuS↓+ 2H+
C.FeS + 2H+= Fe2++ H2S↑
D.Zn2++ S2-+ 2H2O = Zn(OH)2↓+ H2S↑
难度: 中等查看答案及解析
-
对某一可逆反应来说,其他条件不变时,使用催化剂( )
①可以提高反应物的平衡转化率
②可以同等程度改变正逆反应的速率
③增大正反应速率,减小逆反应速率
④不能改变平衡混合物的组成
⑤不能使化学平衡发生移动
⑥改变反应的ΔH
A.①②⑤ B.①③⑤⑥ C.②④⑥ D.②④⑤
难度: 简单查看答案及解析
-
在25 ℃时,电解含有0.02 mol CuSO4和0.04 mol NaCl的混合溶液200 mL,当阳极产生672 mL(标准状况下)气体时,假设忽略溶液体积变化及氯气的溶解,判断电解后溶液的酸碱性为( )
A.酸性 B.碱性 C.中性 D.无法判断
难度: 困难查看答案及解析
-
关于同分异构体的下列说法中不正确的是( )
A.具有相同分子式,但结构不同的化合物互为同分异构体
B.同分异构体现象是导致有机物数目众多的重要原因之一
C.同分异构体之间的转化属于化学变化
D.金刚石、石墨化学式相同,但结构不同,性质不同,所以互为同分异构体
难度: 简单查看答案及解析
-
如图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(1)中加入CaO,在(2)中不加其他任何物质,在(3)中加入NH4Cl晶体,发现(1)中红棕色变深,(3)中红棕色变浅。[已知反应2NO2(红棕色) ⇌N2O4(无色)]
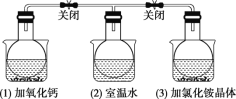
下列叙述正确的是( )
A.2NO2⇌N2O4是放热反应
B.NH4Cl溶于水时放出热量
C.烧瓶(1)中平衡混合气体的平均相对分子质量增大
D.烧瓶(3)中气体的压强增大
难度: 中等查看答案及解析
-
反应4A(g)+5B(g)
4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是( )
A. A的平均反应速率是0.010 mol•L﹣1•s﹣1
B. 容器中含D物质的量至少为0.45 mol
C. 容器中A、B、C、D的物质的量的比一定是4∶5∶4∶6
D. 容器中A的物质的量一定增加了0.30 mol
难度: 中等查看答案及解析
-
已知723 K时,2SO2(g)+O2(g)
2SO3(g)ΔH=﹣QkJ·mol-1,在相同条件下,向一密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1 mol SO2和0.5 mol O2,达到平衡时放出的热量为Q2kJ.则Q1、Q2、Q满足的关系是
A.Q2=Q1/2 B.Q2>Q1/2 C.Q2<Q1<Q D.Q=Q1>Q2
难度: 中等查看答案及解析
-
已知热化学方程式C2H2(g)+
O2(g)=2CO2(g)+H2O(g) ΔH=-1256kJ·mol-1,下列说法正确的是( )
A.乙炔的燃烧热为-1256kJ·mol-1
B.若转移10mol电子,则消耗2.5molO2
C.若生成2mol液态水,则ΔH=-2512kJ·mol-1
D.若形成4mol碳氧共用电子对,则放出的热量为2512kJ
难度: 中等查看答案及解析
-
化学与社会、生产、生活密切相关。下列说法正确的是
A.碳纤维是一种新开发的材料,它属于合成有机高分子化合物
B.对“地沟油”进行分馏可得到汽油
C.漂白粉长期暴露在空气中最后会变质失效
D.氯气溶于水生成次氯酸有强氧化性,可以起到除去水中杂质和杀菌消毒作用
难度: 简单查看答案及解析
-
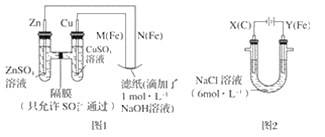
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是
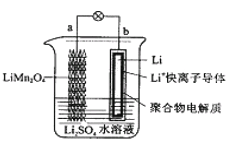
A.a为电池的正极
B.电池充电反应为LiMn2O4
Li1-xMn2O4+xLi
C.放电时,a极锂的化合价发生变化
D.放电时,溶液中Li+从b向a迁移
难度: 中等查看答案及解析
-
在一个固定容积的密闭容器中,保持一定温度进行如下反应:H2(g)+Br2(g)
2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成xmol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是( )
①a、b、c应满足的关系是4a+c=2b
②平衡时HBr为xmol
③a、b、c应满足的关系是a+b=c
④平衡时HBr为
xmol
A.① B.①② C.①④ D.②③
难度: 中等查看答案及解析
-
间二甲苯苯环上的一个氢原子被—NO2取代后,其一元取代产物有( )
A. 1种 B. 2种 C. 3种 D. 4种
难度: 简单查看答案及解析
-
关于钢铁腐蚀与防护的说法不正确的是
A.钢铁的吸氧腐蚀和析氢腐蚀的负极反应式均为:Fe-2e-= Fe2+
B.钢铁发生吸氧腐蚀时,正极反应式为:O2+2H2O+4e-= 4OH-
C.地下钢管连接镁块是采用牺牲阳极的阴极保护法
D.用外加电流的阴极保护法防止钢铁腐蚀时,钢铁接电源的正极
难度: 简单查看答案及解析
-
在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀,已知有关物质的溶度积Ksp(25℃)如下:
物质
AgCl
AgI
Ag2S
Ksp
1.8×10-10
1.5×10-14
1.8×10-20
下列论述错误的是( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl,CaCl2溶液中的溶解度不相同
D.25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度相同
难度: 中等查看答案及解析
-
下列各组物质中属于醇类。但不是同系物的是( )
A.C2H5OH和CH3OCH3
B.CH3OH和CH3CH(OH)CH3
C.CH3CH2OH和CH2=CHCH2OH
D.CH2OHCH2OH和CH2CH(OH)CH2OH
难度: 中等查看答案及解析
-
要使工业废水中的重金属Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:
化合物
PbSO4
PbCO3
PbS
溶解度/g
1.03×10-4
1.81×10-7
1.84×10-14
由上述数据可知,选用的沉淀剂最好为( )
A.硫化物 B.硫酸盐 C.碳酸盐 D.以上沉淀剂均可
难度: 中等查看答案及解析
-
某温度下,在容积可变的容器中,反应2A(g)+B(g)
2C(g)达到平衡时,A、B和C的物质的量分别为4mol,2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡向左移动的是( )
A.均减半 B.均加半 C.均增加1mol D.均减少1mol
难度: 中等查看答案及解析
-
能证明氟化氢是弱电解质的事实是( )
A.氟化氢在所有卤化氢中热稳定性最强
B.浓H2SO4加入氟化钙固体中,加热,有氟化氢气体产生
C.100mL0.1mol·L-1氢氟酸中,c(H+)小于0.1mol·L-1
D.在氢氟酸中滴加含酚酞的NaOH溶液,红色褪去
难度: 中等查看答案及解析
-
下列各种说法中正确的是( )
A.苯酚有弱酸性,俗称石炭酸,因此它是一种羧酸
B.凡是能起银镜反应的物质一定是醛
C.在酯化反应中,羧酸脱去羧基中的氢原子,醇脱去羟基生成水和酯
D.乙烯和甲苯都能使酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
铁在下列情况下腐蚀最快的是( )
A.铁放入海水中 B.铁和锌连接放入水中
C.铁和锡连接放入海水中 D.铁和锡连接放入淡水中
难度: 简单查看答案及解析
-
化学平衡常数可以用K来表示,下列关于化学平衡常数的说法中正确的是( )
A.K越大,反应物的转化率越小 B.K与反应物的浓度有关
C.K与生成物的浓度有关 D.K与温度有关
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.一般沉淀离子浓度小于10-5mol·L-1时,则认为已经沉淀完全
B.反应AgCl+NaBr=AgBr+NaCl能在水溶液中能进行,是因为AgCl比AgBr更难溶于水
C.Al(OH)3(s)
Al3+(aq)+3OH-(aq)表示沉淀溶解平衡,Al(OH)3
Al3++3OH-表示水解平衡
D.只有反应速率很高的化学反应才能应用于工业生产
难度: 简单查看答案及解析
-
下列关于有机化合物的说法正确的是( )
A.乙醇是一种可再生能源
B.汽油、柴油和植物都是碳氢化合物
C.苯能使酸性的KMnO4溶液褪色
D.甲烷、乙烯和苯在工业上都可通过石油分馏得到
难度: 中等查看答案及解析