-
某化合物由五种短周期元素组成,分别为X、Y、Z、W、R,原子序数依次增大。X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,电子层数等于主族序数,W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是
A. Z与Y形成的化合物是工业上制取Z的原料
B. WY2可与酸反应,但不能与碱反应
C. 原子半径按X、Y、Z、R、W的顺序依次增大
D. 热稳定性 :X2R>X2Y
难度: 简单查看答案及解析
-
我国科学家成功地研制出长期依赖进口、价格昂贵的物质
,下列说法正确的是()
A. 它与
的物理性质完全相同 B. 它是O3的一种同素异形体
C.
与
互为同位素 D. 1mol
分子中含有20mol电子
难度: 简单查看答案及解析
-
W、X、Y、Z四种短周期主族元素在周期表中的相对位置如图所示,由此可知( )
X
Y
W
Z
A.Z元素氢化物的水溶液一定是强酸
B.四种元素原子形成的简单离子,半径最小的一定是Y
C.四种元素最高价氧化物对应的水化物酸性最强的一定是Y
D.四种元素对应的简单氢化物稳定性最强的一定是Y
难度: 中等查看答案及解析
-
下列有关热化学方程式的叙述正确的
A. 已知2H2O(l)==2H2(g)+O2(g) △H=+571.6KJ·mol-1,无法求H2的燃烧热
B. 已知C(石墨,s)=C(金刚石,s) △H>0,无法比较二者的稳定性
C. 已知500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放出19.3KJ的热量,无法推出该反应的热化学方程式
D. 已知2C(s)+2O2(g)==2CO2(g) △H1;2C(s)+2O2(g)="=2CO(g)" △H2,无法得出△H2>△H1
难度: 中等查看答案及解析
-
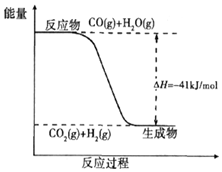
反应2C+O2===2CO的能量变化如下图所示。下列说法正确的是( )
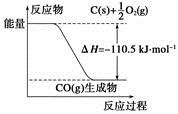
A. 12 g C(s)与一定量O2(g)反应生成14 g CO(g)放出的热量为110.5 kJ
B. 该反应的热化学方程式是2C(s)+O2(g)===2CO(g) ΔH=-221 kJ
C. 2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ
D. 该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差
难度: 中等查看答案及解析
-
下列关于金属腐蚀的叙述正确的是( )
A. 金属在潮湿情况下的腐蚀实质是M+nH2O====M(OH)n+
H2↑
B. 金属的化学腐蚀实质是M-ne-
Mn+,电子直接转移给氧化剂
C. 金属的化学腐蚀必须在酸性条件下进行
D. 在潮湿的中性环境中,金属的电化学腐蚀主要是吸氧腐蚀
难度: 中等查看答案及解析
-
利用如图所示装置模拟电解原理在工业生产上的应用,下列说法正确的是
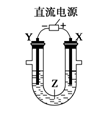
A. 氯碱工业中,X电极上反应式是4OH--4e-=2H2O+O2↑
B. 电解精炼铜时,Z溶液中的Cu2+浓度不变
C. 在铁片上镀铜时,Y是纯铜
D. 制取金属镁时,Z是熔融的氯化镁
难度: 中等查看答案及解析
-
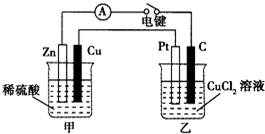
某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
A. 正极反应式为:O2+2H2O+4e-=4OH-
B. 工作一段时间后,电解液中KOH的物质的量不变
C. 该燃料电池的总反应方程式为:2H2+O2=2H2O
D. 用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
难度: 中等查看答案及解析
-
铅蓄电池是常见的二次电池,目前汽车上使用的电瓶大多数是铅蓄电池。已知铅蓄电池的电解质溶液为硫酸溶液,其充、放电按下式进行:Pb(s)+PbO2(s)+2H2SO4(aq)
2PbSO4(s)+2H2O(1),下列有关该电池的说法正确的是
A. 放电时,溶液中H+向PbO2电极迁移
B. 放电时,电路中转移0.2mol电子时Pb电极质量减小20.7g
C. 充电时,电解质溶液的pH增大
D. 充电时,阴极的电极反应式为:PbSO4+2H2O-2e-=PbO2+4H++SO42-
难度: 中等查看答案及解析
-
家里的食用花生油不小心混入了大量的水,采用最简便的分离方法是
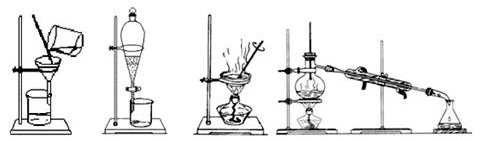
A B C D
难度: 简单查看答案及解析
-
在 2L 的密闭容器中发生反应:4A(s)+3B(g)⇌2C(g)+D(g),2min后B减小了 1.2mol.有关此反应的说法正确的是( )
A. 在 2min 内的反应速率,用 C 表示是 0.4mol/(L•min)
B. 分别用 B、C、D 表示化学反应速率其比值是 3:2:1
C. 达到化学反应限度时,B 物质转化率为 100%
D. 向容器中增加 A 的投量,可以加快该反应的速率
难度: 中等查看答案及解析
-
控制变量法是科学研究中的一种常用方法,下表中产生H2速率最快的是
编号
金属(粉末状)
物质的量
酸的浓度
酸的体积
反应温度
A
Al
0.2 mol
18.4mol/L H2SO4
10mL
30℃
B
Mg
0.2 mol
3 mol/L H2SO4
20mL
30℃
C
Fe
0.1 mol
3 mol/L H2SO4
20mL
60℃
D
Mg
0.1 mol
3 mol/L H2SO4
10mL
60℃
难度: 中等查看答案及解析
-
在不同条件下分别测得反应2A(g)+3B(g)
C(g)+2D(g)的化学反应速率,其中表示该反应进行的最快的是
A. v(A)=3mol•L﹣1•min﹣1
B. v(B)=6mol•L﹣1•min﹣1
C. v(C)=2.5mol•L﹣1•min﹣1
D. v(D)=4mol•L﹣1•min﹣1
难度: 中等查看答案及解析
-
对于在密闭容器中进行的可逆反应2SO2(g)+18O2(g)⇌2SO3(g),下列说法正确的是( )
A. 容器内只含有18O2、SO2、SO3三种分子
B. 18O只存在18O2分子中
C. 容器内含有18O2、S18O2、S18O3等分子
D. 反应达到限度时,所有物质的质量都相等
难度: 中等查看答案及解析
-
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)
2CO2(g)+S(s)
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A. 平衡前,随着反应的进行,容器内压强始终不变
B. 平衡时,其他条件不变,分离出硫,正反应速率加快
C. 平衡时,若升高温度,CO体积分数增大,则该反应的△H>0
D. 其他条件不变,增大压强,该反应平衡常数不变
难度: 困难查看答案及解析
-
一定条件下,容积为1L的密闭容器中发生反应:
SiF4(g)+2H2O(g)
SiO2(s)+4HF(g) △H="+148.9" kJ·mol-1
下列各项中不能说明该反应已达化学平衡状态的是( )
A. v(SiF4)消耗=4v(HF)生成 B. HF的体积分数不再变化
C. 容器内气体压强不再变化 D. 容器内气体的总质量不再变化
难度: 中等查看答案及解析
-
298K时,已知反应N2(g)+3H2(g)⇌2NH3(g)△H=-92.3kJ•mol-1,平衡常数K=4.下列说法正确的是( )
A. 使用催化剂会使K变化但△H不变
B. 使用催化剂会使△H增大,但K不变
C. 使用催化剂和提高温度均可增大H2的转化率
D. 在一密闭容器中,投入浓度均为1mol•L-1的 N2、H2、NH3,平衡前v(正)>v(逆)
难度: 中等查看答案及解析
-
t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)
2Z(g),各组分在不同时刻的浓度如下表:
物质
X
Y
Z
初始浓度/(mol·L-1)
0.1
0.2
0
2min末浓度/(mol·L-1)
0.08
a
b
平衡浓度/(mol·L-1)
0.05
0.05
0.1
下列说法正确的是
A.平衡时,X的转化率为20%
B.2min时Y的物质的量为0.14
C.增大平衡后的体系压强,v(正)增大,v(逆)减小
D.2min内,用Y的变化量表示的平均反应速率v(Y)=0.03mol·L―1·min―1
难度: 中等查看答案及解析
-
已知:xA(g)+yB(g)
zC(g);△H=a。将xmolA和ymolB混合在密闭容器中,在不同温度(T1>T2)及压强(P1>P2)下,C的物质的量n(C)与反应时间(t)的关系如图所示。下列判断正确的是
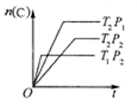
A. x+y=z;a>0 B. x+y>z;a<0
C. x+y<z;a<0 D. x+y<z;a>0
难度: 中等查看答案及解析
-
向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)
CH3OH(g) △H<0。L(L1、L2)、X可分别代表压强或温度,下图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系。
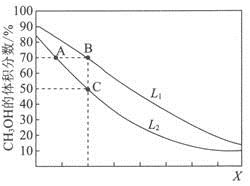
下列说法中,正确的是( )
A. X代表压强 B. L1<L2
C. 平衡常数:K(A)=K(B) D. 在C点时,CO转化率为75%
难度: 困难查看答案及解析