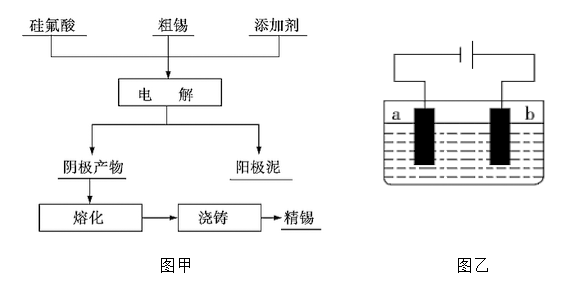
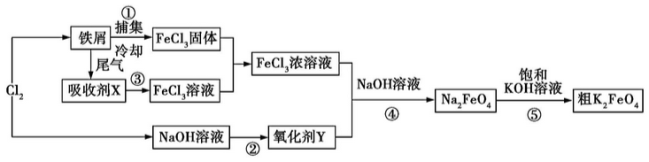
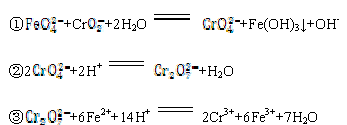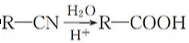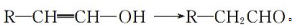-
食品干燥剂应无毒、无味、无腐蚀性及环境友好。下列说法错误的是
A.硅胶可用作食品干燥剂
B.P2O5不可用作食品干燥剂
C.六水氯化钙可用作食品干燥剂
D.加工后具有吸水性的植物纤维可用作食品干燥剂
难度: 中等查看答案及解析
-
氯化钠是海水的主要成分,也是人类生活中不能缺少的一种物质。下列关于氯化钠的说法正确的是
A.氯化钠溶液能导电,所以氯化钠溶液是电解质
B.氯化钠溶液可杀菌,说明氯化钠溶液具有强氧化性
C.电解熔融氯化钠和电解氯化钠溶液的产物相同
D.加碘食盐是指添加了碘的化合物的氯化钠
难度: 中等查看答案及解析
-
下列有关化学用语的表示正确的是
A.钠原子的结构示意图为

B.过氧化氢的电子式为
C.聚乙烯的结构简式为
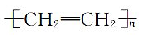
D.淀粉和纤维素的实验式都为CH2O
难度: 中等查看答案及解析
-
有机物甲的分子式为C7H12O2,是一种六元环状酯,且甲的分子中含有2 个甲基,则甲的可能结构有
A.6 种 B.8 种 C.10 种 D.14 种
难度: 中等查看答案及解析
-
下列表格中的对应关系正确的是
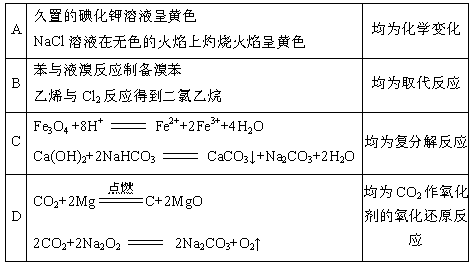
难度: 中等查看答案及解析
-
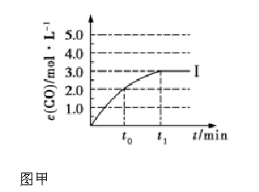
一定温度下,在体积可变的恒温密闭容器中,甲醇在浓硫酸作催化剂的条件下发生下列反应:2CH3OH(g)=CH3OCH3(g)+H2O(g)ΔH=-25 kJ·mol-1
下列有关该反应的叙述正确的是
A.该条件下,1 mol CH3OH(g)参加反应,放出的热量为25 kJ
B.若不采用合适的催化剂,该反应中甲醇的转化率将降低
C.升高温度和增大压强(缩小容器容积)均可加快反应速率
D.反应过程中,2v(CH3OH)=v(CH3OCH3)
难度: 中等查看答案及解析
-
下列有关仪器的使用或操作正确的是
A.烧杯、烧瓶、锥形瓶均可加垫石棉网加热
B.试剂瓶可以用于存放、溶解、稀释药品
C.用容量瓶配制溶液时,加入蒸馏水需要用玻璃棒引流,加至刻度线
D.用滴定管量取液体时,开始读数和最后读数均俯视,则量取的体积准确
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.氯气溶解于水:Cl2+H2O =HClO+Cl-+H+
B.沸水中滴入饱和FeCl3 溶液,溶液呈红褐色:Fe3++3H2O= Fe(OH)3↓+3H+
C.醋酸钠溶液显碱性:CH3COO-+H2O =CH3COOH+OH-.
D、久置的H2S 溶液变浑浊:2S2-+O2+4H+ =2S↓+2H2O
难度: 中等查看答案及解析
-
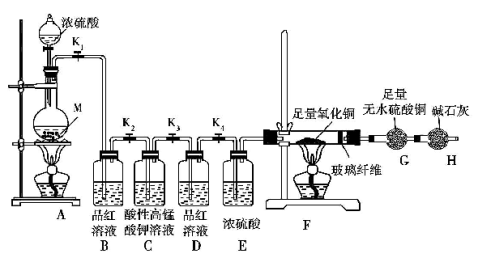
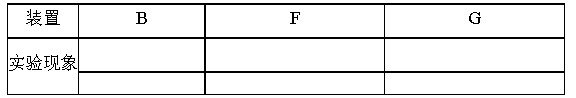
下面是四位同学为验证某无色气体为SO2而进行的实验设计,其中能够充分说明该气体是SO2的是
①甲同学将气体通入酸性KMnO4 溶液中,溶液褪色,再滴入BaCl2 溶液,出现白色沉淀;
②乙同学用湿润的蓝色石蕊试纸检验该气体,试纸变红;
③丙同学将气体通入品红溶液,溶液褪色,加热后又恢复红色;
④丁同学将气体通入溴水中,溴水褪色,再滴加酸化的氯化钡溶液有白色沉淀生成
A.①②③④ B.①③④ C.③④ D.②③④
难度: 中等查看答案及解析
-
设NA 表示阿伏加德罗常数的值,下列说法正确的是
A.2.8 g 一氧化碳和乙烯的混合气体中所含的碳原子数目为0.1NA
B.标准状况下5.6 L N2O 气体所含的电子数为5.5NA
C.用惰性电极电解CuCl2溶液阴极得到0.1NA 个Cu 原子时,阳极生成2.24 L 气体
D.0.1 mol·L-1 的NaCl 溶液中,Na+与Cl-的总数目为0.2NA
难度: 中等查看答案及解析
-
金合欢醇广泛应用于多种香型的香精中,其结构简式如图所示。下列说法正确的是
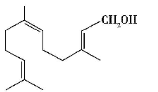
A.金合欢醇与乙醇是同系物
B.金合欢醇可发生加成反应,但不能发生取代反应
C.1 mol 金合欢醇能与3 mol H2 反应,也能与3 mol Br2 反应
D.1 mol 金合欢醇与足量Na 反应生成0.5 mol 氢气,与足量NaHCO3溶液反应生成1molCO2
难度: 中等查看答案及解析
-
X、Y、Z、W 均为主族元素,其原子序数依次增大,且原子序数均小于或等于20。X、Z 处于同一主族,Y、Z 处于同一周期,X 为地壳中含量最多的元素,Y、W 在化合物中均只有一种化合价,分别为+1 和+2。下列说法正确的是
A.原子半径:Z>Y>X
B.X、Y 形成的化合物均为离子化合物,其结构中只有离子键
C.最外层电子数:X=Z>W>Y
D.最高正化合价:X=Z>W>Y
难度: 中等查看答案及解析
-
科技工作者研究出以NH3 为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示)。该固体氧化物电解质的工作温度高达700~900 ℃,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是
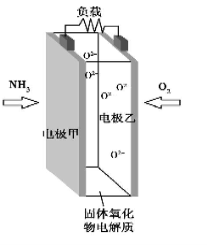
A.电极甲为电池正极
B.电池总反应为4NH3+5O2 =4NO+6H2O
C.电池正极反应式为O2+2H2O+4e-=4OH-
D.图示中的O2-由电极乙移向电极甲
难度: 中等查看答案及解析
-
已知下列四个热化学方程式:
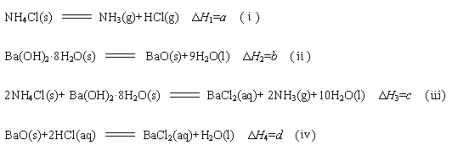
其中a、b、c 均大于0,HCl气体溶解于水,溶液温度升高。由此可知下列判断一定正确的是
A.d<0 B.c<2a+b-d C.c=2a+b+d D.c>2a+b-d
难度: 中等查看答案及解析
-
已知25 ℃下,Ka(HCOOH)=1.78×10-4,Kb(NH3·H2O)=1.79×10-5。保持25 ℃不变,向一定体积0.1 mol·L-1 的氨水中滴加0.1 mol·L-1 的甲酸溶液。在滴加过程中
A.水的电离常数先增大后减小
B.当氨水和甲酸溶液体积相等时,c(HCOO-)=c(NH4+)
C.c(NH3·H2O)与c(NH4+)之和始终保持不变
D.
始终保持不变
难度: 中等查看答案及解析
-
Cu 与浓硝酸反应生成氮的氧化物,这些氧化物恰好溶解在NaOH 溶液中得到NaNO3和NaNO2的混合溶液,反应过程及有关数据如图所示:
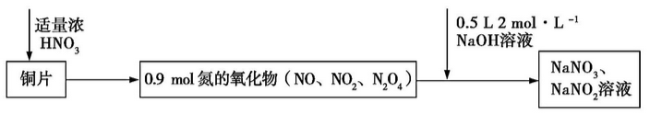
下列有关判断正确的是
A.若铜片为51.2 g,则生成0.2 mol NaNO3
B.常温下,Cu 遇浓硝酸发生钝化,不可能发生上述反应
C.标准状况下收集的氮氧化物为20.16 L
D.反应过程中生成的Cu(NO3)2 既是氧化产物,也是还原产物
难度: 中等查看答案及解析