-
化学反应原理在合成氨工业及氨的性质研究中具有广泛的应用。
(1)工业生产硝酸的第一步反应是氨的催化氧化反应,已知下列3 个热化学方程式(K 为平衡常数):

(2)工业合成氨所用的氢气主要来自天然气与水的反应,但这种原料气中往往混有一氧化碳杂质,工业生产中通过如下反应来除去原料气中的CO:CO(g)+H2O(g) CO2(g)+ H2 (g)ΔH<0。
CO2(g)+ H2 (g)ΔH<0。
①一定条件下,反应达到平衡后,欲提高CO 的转化率,可采取的措施有 、 。
②在容积为2 L 的密闭容器中发生上述反应,其中c(CO)随反应时间(t)的变化如图甲中曲线Ⅰ,如果在t0时刻将容器容积扩大至4 L,请在图甲中画出t0时刻后c(CO)随反应时间(t)的变化曲线。
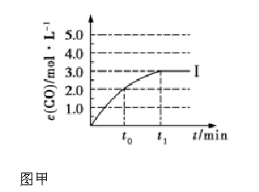
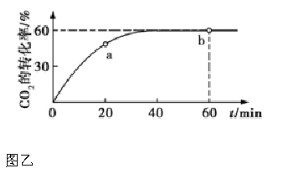
(3)氨气的重要用途是合成尿素,一定条件下,NH3和CO2 合成尿素的反应为 。当加料比例n(NH3)/n(CO2)=4 时,CO2的转化率随反应时间(t)的变化如图乙所示,a 点v 逆(CO2) b 点v 正(CO2)(填“>”、“<”或“=”),NH3的平衡转化率为 。
。当加料比例n(NH3)/n(CO2)=4 时,CO2的转化率随反应时间(t)的变化如图乙所示,a 点v 逆(CO2) b 点v 正(CO2)(填“>”、“<”或“=”),NH3的平衡转化率为 。
(4)硫酸工业生产过程中产生的尾气可用氨水吸收,生成的(NH4)2SO3再与硫酸反应,将生成的SO2返回车间作生产硫酸的原料,而生成的(NH4)2SO4可作肥料。常温下,0.1mol·L-1(NH4)2SO4 溶液中各离子浓度由大到小的顺序是 ;
若某工厂中使用的是室温下0.1 mol·L-1 的氨水,那么该氨水的pH= 。
(已知
-
硝酸铈铵[(NH4)2Ce(NO3)6]广泛应用于电子、催化工业,其合成路线如下:

(1)已知(NH4)2Ce(NO3)6受热易分解,某科研小组认为反应原理如下,请补充完整:(NH4)2Ce(NO3)6 CeO2·8OH + 8_____↑;CeO2·8OH
CeO2·8OH + 8_____↑;CeO2·8OH CeO2+ 4H2O↑+2O2↑。
CeO2+ 4H2O↑+2O2↑。
在空气中加热(NH4)2Ce(NO3)6,除固体颜色有变化外,还可观察到的现象是_________。
(2)步骤Ⅰ中,将Ce(NO3)3·6H2O配成溶液,保持pH到4~5,缓慢加入H2O2溶液搅拌混合均匀,再加入氨水调节溶液pH,得到Ce(OH)4沉淀。该过程中参加反应的氧化剂与还原剂物质的量之比为___________。
(3)298K时,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4的溶度积表达式为Ksp=___________。
为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10—5mol·L-1,需调节pH为______以上。
(4)为了研究步骤Ⅲ的工艺条件,科研小组测定了(NH4)2Ce(NO3)6在不同温度、不同浓度硝酸中的溶解度,结果如图。从图中可得出三条主要规律:
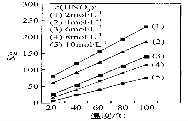
① (NH4)2Ce(NO3)6在硝酸中的溶解度随温度升高而增大;
② _____________________________________________;
③ _____________________________________________。
-
硝酸铈铵[(NH4)2Ce(NO3)6]广泛应用于电子、催化工业,其合成路线如下:

(1)已知(NH4)2Ce(NO3)6受热易分解,某科研小组认为反应原理如下,请补充完整:(NH4)2Ce(NO3)6 CeO2·8OH + 8_____↑;CeO2·8OH
CeO2·8OH + 8_____↑;CeO2·8OH CeO2+ 4H2O↑+2O2↑。
CeO2+ 4H2O↑+2O2↑。
在空气中加热(NH4)2Ce(NO3)6,除固体颜色有变化外,还可观察到的现象是_________。
(2)步骤Ⅰ中,将Ce(NO3)3·6H2O配成溶液,保持pH到4~5,缓慢加入H2O2溶液搅拌混合均匀,再加入氨水调节溶液pH,得到Ce(OH)4沉淀。该过程中参加反应的氧化剂与还原剂物质的量之比为___________。
(3)298K时,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4的溶度积表达式为Ksp=___________。
为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10—5mol·L-1,需调节pH为______以上。
(4)为了研究步骤Ⅲ的工艺条件,科研小组测定了(NH4)2Ce(NO3)6在不同温度、不同浓度硝酸中的溶解度,结果如图。从图中可得出三条主要规律:
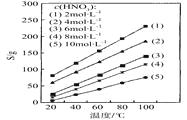
① (NH4)2Ce(NO3)6在硝酸中的溶解度随温度升高而增大;
② _____________________________________________;
③ _____________________________________________。
-
工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物NOx(NO和NO2的混合物,假设不含N2O4)的处理与应用也是科学研究的热点。
⑴工业上可用氨催化吸收法处理NOx,反应原理为4xNH3+6NOx (2x+3)N2+6xH2O。某化学兴趣小组模拟该处理过程的实验装置如图所示:
(2x+3)N2+6xH2O。某化学兴趣小组模拟该处理过程的实验装置如图所示:
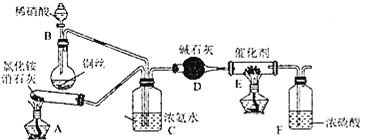
①装置A中发生反应的化学方程式为________。
②装置D中碱石灰的作用是________。
⑵工业上也常用Na2CO3溶液吸收法处理NOx(已知:NO不能与Na2CO3溶液反应)。NO+NO2+ Na2CO3 = 2 NaNO2+ CO2;
2NO2+ Na2CO3 = NaNO2+ NaNO3+ CO2。
①当NOx被Na2CO3溶液完全吸收时,x的值不可能是________ 填选项字母
填选项字母 。
。
A.1.4 B.1.6 C.1.8
②将1 mol NOx通入Na2CO3溶液中,被完全吸收时,溶液中生成的NO3-、NO2-两种离子的物质的量随x变化关系如图所示:
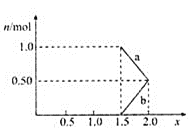
图中线段a表示________ 填化学式
填化学式 随x值的变化关系;若用溶质质量分数为21.2%的Na2CO3溶液吸收,则需要Na2CO3溶液至少________g。
随x值的变化关系;若用溶质质量分数为21.2%的Na2CO3溶液吸收,则需要Na2CO3溶液至少________g。
 用足量的Na2CO3溶液完全吸收NOx,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则NOx中的
用足量的Na2CO3溶液完全吸收NOx,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则NOx中的 ________。
________。
⑶氨催化吸收法和Na2CO3溶液吸收法处理NOx尾气的意义是________。
⑷尿素也可用于吸收处理NOx,其反应原理为NO+NO2+ H2O = 2HNO2、2HNO2+CO(NH2)2 = 3H2O + CO2↑+ 2N2↑。当混合气体中NO、NO2按上述反应中系数比时吸收效果最佳。若混合气体中V(NO):V(NO2)=5:1时,可通入一定量的空气,同温同压下,V(空气):V(NO)= ________ (空气中O2的体积含量约为20%)。
-
(6分)随着我国工业化水平的不断发展,研究空气污染、废水处理等问题成为重要课题。
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
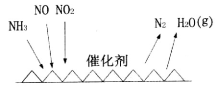
①SCR技术中的氧化剂为____________
②当NO2与NO的物质的量之比为1:l时,与足量氨气在一定条件下发生反应。该反应的化学方程式为_______。当有3 mol电子发生转移时,则参与反应的NO的物质的量为________。
(2)电镀废水中常含有毒的NaCN、HCN等。NaCN水溶液显碱性的原因是_____________(用离子方程式表示);HCN的Ka=6.17×10-10,用NaOH溶液调节含CN-的废水至pH=9,此时废水中c(CN-)_______c(HCN)(填“>”、“<”或“=”)。
(3)室温下有如下数据:草酸(H2C2O4)的K1=5.4×10-2,K2=5.4×10-5;醋酸的电离平衡常数K=1.75×10-5;碳酸的电离平衡常数K1=4.2×10-7,K2=4.5×10-11;Ksp(CaC2O4)=5.0×10-9;Ksp (CaCO3)=2.5×10-9
①用醋酸溶液鉴别CaC2O4和CaCO3两种白色固体的实验现象是___________;
②向0.6 mol·L-1的Na2CO3溶液中加入足量CaC2O4粉末后(忽略溶液体积变化),充分搅拌,发生反应:CO32-(aq)+ CaC2O4 (s) CaCO3 (s)+ C2O42-(aq),静置后沉淀转化达到平衡,此时溶液中的c(C2O42-)(不考虑其他诸如水解之类副反应)为_____________。
CaCO3 (s)+ C2O42-(aq),静置后沉淀转化达到平衡,此时溶液中的c(C2O42-)(不考虑其他诸如水解之类副反应)为_____________。
-
碳及其化合物在有机合成、能源开发等工农业方面具有十分广泛的应用。
I.工业生产精细化工产品乙二醛(OHC-CHO)
(1)乙醇(CH3CH2OH)液相硝酸氧化法:在Cu(NO3)2催化下,用稀硝酸氧化乙醇制取乙二醛,此反应的化学方程式为_______________。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点____________。
(2)乙二醇(HOCH2CH2OH)气相氧化法
已知:2H2(g)+O2(g)  2H2O(g) ΔH=-484kJ/mol,化学平衡常数为K1
2H2O(g) ΔH=-484kJ/mol,化学平衡常数为K1
OHC-CHO(g)+2H2(g)  HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g)  OHC-CHO(g)+2H2O(g)的ΔH=______;相同温度下,该反应的化学平衡常数K=______(用含K1、K2的代数式表示)。
OHC-CHO(g)+2H2O(g)的ΔH=______;相同温度下,该反应的化学平衡常数K=______(用含K1、K2的代数式表示)。
Ⅱ.CO2的综合利用
(3)一定量的CO2与足量的碳在体积可变的恒压密闭容器中发生反应C(s)+CO2(g) 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。
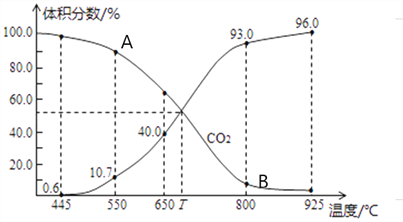
a.反应达平衡状态时,混合气体的平均相对分子质量保持不变
b.A点的正反应速率比B点正反应速率小
C.550℃时,若充入氦气,则V正、V逆均减小,平衡不移动
d.T℃时,反应达平衡后CO2的转化率为66.7%
e. T℃时,若再充入1molCO2和1molCO,平衡不移动
(4)氨气、CO2在一定条件下可合成尿素,其反应为2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
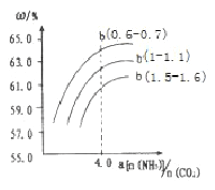
①b应控制在______
a.1.5-1.6 b.1-1.1 c.0.6-0.7
②a应控制在4.0的理由是_________
-
碳及其化合物在有机合成、能源开发等工农业方面具有十分广泛的应用。
I.工业生产精细化工产品乙二醛(OHC-CHO)
(1)乙醇(CH3CH2OH)液相硝酸氧化法:在Cu(NO3)2催化下,用稀硝酸氧化乙醇制取乙二醛,此反应的化学方程式为_______________。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点____________。
(2)乙二醇(HOCH2CH2OH)气相氧化法
已知:2H2(g)+O2(g)  2H2O(g) ΔH=-484kJ/mol,化学平衡常数为K1
2H2O(g) ΔH=-484kJ/mol,化学平衡常数为K1
OHC-CHO(g)+2H2(g)  HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g)  OHC-CHO(g)+2H2O(g)的ΔH=______;相同温度下,该反应的化学平衡常数K=______(用含K1、K2的代数式表示)。
OHC-CHO(g)+2H2O(g)的ΔH=______;相同温度下,该反应的化学平衡常数K=______(用含K1、K2的代数式表示)。
Ⅱ.CO2的综合利用
(3)一定量的CO2与足量的碳在体积可变的恒压密闭容器中发生反应C(s)+CO2(g) 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。

a.反应达平衡状态时,混合气体的平均相对分子质量保持不变
b.A点的正反应速率比B点正反应速率小
C.550℃时,若充入氦气,则V正、V逆均减小,平衡不移动
d.T℃时,反应达平衡后CO2的转化率为66.7%
e. T℃时,若再充入1molCO2和1molCO,平衡不移动
(4)氨气、CO2在一定条件下可合成尿素,其反应为2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
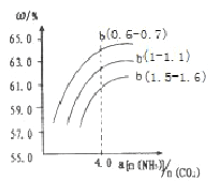
①b应控制在______
a.1.5-1.6 b.1-1.1 c.0.6-0.7
②a应控制在4.0的理由是_________
-
 作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
(1)催化剂常具有较强的选择性,即专一性。已知:
反应I: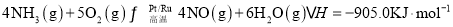
反应 II: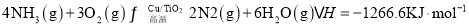
写出NO分解生成 与
与 的热化学方程式______。
的热化学方程式______。
(2)在恒温恒容装置中充入一定量的 和
和 ,在某催化剂的作用下进行反应I,测得不同时间的
,在某催化剂的作用下进行反应I,测得不同时间的 和
和 ,的浓度如表:
,的浓度如表:
则下列有关叙述中正确的是______。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内 时,说明反应已达平衡
时,说明反应已达平衡
C.当容器内 时,说明反应已达平衡
时,说明反应已达平衡
D.前10分钟内的平均速率

(3)氨催化氧化时会发生上述两个竞争反应I、 为分析某催化剂对该反应的选择性,在1L密闭容器中充入1mol
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1mol  和2mol
和2mol  ,测得有关物质的量关系如图1:
,测得有关物质的量关系如图1:
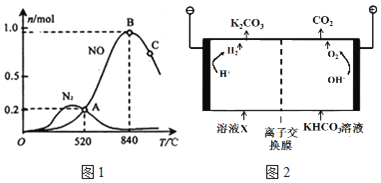
①该催化剂在低温时选择反应______ 填“I”或“II”
填“I”或“II” 。
。
② 时,
时, 的平衡常数
的平衡常数 ______
______ 不要求得出计算结果,只需列出数字计算式
不要求得出计算结果,只需列出数字计算式 。
。
③ 点比B点所产生的NO的物质的量少的主要原因______。
点比B点所产生的NO的物质的量少的主要原因______。
(4)合成氨工业会产生大量副产物 ,工业上常用高浓度的
,工业上常用高浓度的 溶液吸收
溶液吸收 ,得溶液X,再利用电解法使
,得溶液X,再利用电解法使 溶液再生,其装置如图2所示:
溶液再生,其装置如图2所示:
①在阳极区发生的反应包括______和 。
。
②简述 在阴极区再生的原理______。
在阴极区再生的原理______。
(5)制备催化剂时常产生一定的废液,工业上常利用氢硫酸检测和除去废液中的 。
。
已知: 时,
时, ,
, ,
,
①在计算溶液中的离子浓度时,涉及弱酸的电离通常要进行近似处理。则 氢硫酸的
氢硫酸的 ______
______ 取近似整数
取近似整数 。
。
②已知,某废液接近于中性,若加入适量的氢硫酸,当废液中 ______
______  计算结果保留两位有效数字
计算结果保留两位有效数字 ,就会产生CuS沉淀。
,就会产生CuS沉淀。
-
硝酸在有机合成、医药化工、化纤等行业应用非常广泛。工业上用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2 4NO+6H2O ----①
4NO+6H2O ----①
4NO+3O2+2H2O→4HNO3----②
完成下列计算:
52、如果以一定量的氨气在一密闭容器中与足量氧气发生上述反应,冷却后所得溶液中溶质的质量分数是_________________(保留2位小数,下同)。
53、现以1.70吨液氨为原料生产硝酸,然后加入4.50吨水,得到密度为1.31g/cm3的硝酸,该硝酸的物质的量浓度是_______mol/L(假设生产过程中反应物和生成物均无损耗)。
54、把22.40 g铁完全溶解于某浓度的硝酸中,反应只收集到 0.30 mol NO2 和0.20 mol NO。通过计算推断反应后溶液中溶质的成分及其物质的量__________(写出计算过程)。
55、硝酸工业尾气中的NO、NO2属于大气的主要污染物。已知1m3硝酸工业的尾气中含3160mg NOx,其中n(NO) : n(NO2) = 9:1。
(1)如果用NaOH溶液完全吸收NOx,至少需要补充标准状况下的富氧空气多少升?
_________________________(富氧空气中O2的体积分数为0.25)(写出计算过程)
(2)如果用氨催化还原法,即用氨作催化剂,将NO、NO2转化为氮气直接排入空气中,需要氨气的质量为多少克?__________________________(写出计算过程)
-
NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863 计划。
(1)催化剂常具有较强的选择性。已知:
反应I:4NH3(g)+5O2(g)  4NO(g)+6H2O(g) △H1=-905kJ·mol-1
4NO(g)+6H2O(g) △H1=-905kJ·mol-1
反应II:4NH3(g)+3O2(g) 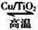 2N2(g)+6H2O(g) △H2=-1266.6kJ·mol-1
2N2(g)+6H2O(g) △H2=-1266.6kJ·mol-1
写出NO 分解生成N2与O2的热化学方程式______________________________________。
(2)N2O也可分解生成N2与O2。在四个恒容密闭容器中按左下表相应量充入气体,发生2N2O(g) 2N2(g)+O2(g),容器I、II、III中N2O平衡转化率如下图所示。
2N2(g)+O2(g),容器I、II、III中N2O平衡转化率如下图所示。
| 容器 | 容积/L | 起始物质的量/mol |
| N2O | N2 | O2 |
| I | V1 | 0.1 | 0 | 0 |
| II | 1.0 | 0.1 | 0 | 0 |
| III | V2 | 0.1 | 0 | 0 |
| IV | 1.0 | 0.06 | 0.06 | 0.04 |
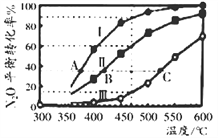
①该反应的△H_________0(填“>”、“=”、“<”);
②图中A、B、C 三点处容器内的总压强,由大到小的顺序是_____________________;
③容器IV在470℃进行反应时,起始速率:v(N2O)正____v (N2O)逆(填“>”、“=”、“<”)。
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在20L密闭容器中充人lmolNH3和2molO2,测得一定时间内有关物质的量关系如图:
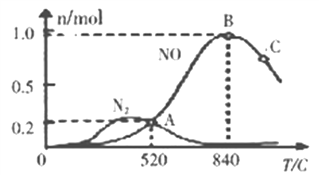
①该催化剂在低温时选择反应________(填“I”或“II”)。
②C点比B点所产生的NO的物质的量少的原因可能是_________________________________。

CO2(g)+ H2 (g)ΔH<0。


。当加料比例n(NH3)/n(CO2)=4 时,CO2的转化率随反应时间(t)的变化如图乙所示,a 点v 逆(CO2) b 点v 正(CO2)(填“>”、“<”或“=”),NH3的平衡转化率为 。











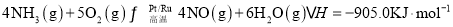
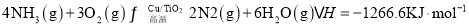

 2N2(g)+6H2O(g) △H2=-1266.6kJ·mol-1
2N2(g)+6H2O(g) △H2=-1266.6kJ·mol-1
