-
2019年7月1日起,上海进入垃圾分类强制时代,随后西安等地也纷纷开始实行垃圾分类。这体现了我国保护环境的决心,而环境保护与化学息息相关,下列有关说法正确的是
A.废弃的聚乙烯塑料属于白色垃圾,不可降解,能使溴水褪色
B.可回收的易拉罐中含金属铝,可通过电解氯化铝制取
C.废旧电池中含有镍、镉等重金属,不可用填埋法处理
D.含棉、麻、丝、毛及合成纤维的废旧衣物燃烧处理时都只生成CO2和H2O
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.蒸发结晶操作时,当水分完全蒸干立即停止加热
B.滴定实验中,可以将待测液放到滴定管中,标准液置于锥形瓶中
C.测定NaClO溶液的pH,可用洁净的玻璃棒蘸取液体滴到pH试纸上,再与标准比色卡对照读数
D.用pH计测定同温度同浓度的Na2CO3溶液和NaCN溶液的pH,通过比较pH大小比较H2CO3、HCN的酸性强弱
难度: 简单查看答案及解析
-
ClO2是一种国际公认的安全、无毒的绿色消毒剂,沸点11℃,凝固点-59℃。工业上,可用下列原理制备ClO2(液相反应):
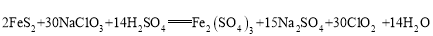 。设NA是阿伏伽德罗常数的值。下列说法正确的是( )
。设NA是阿伏伽德罗常数的值。下列说法正确的是( )A.在标准状况下,2240mL ClO2含有原子数为0.3NA
B.若生成1.5mol Na2SO4,则反应后的溶液中Fe3+数目为0.2NA
C.48.0g FeS2完全反应,则上述反应中转移电子数为6NA
D.每消耗30mol NaClO3,生成的水中氢氧键数目为14NA
难度: 简单查看答案及解析
-
查阅资料可知,苯可被臭氧氧化,发生化学反应为:
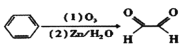 。则邻甲基乙苯通过上述反应得到的有机产物最多有( )
。则邻甲基乙苯通过上述反应得到的有机产物最多有( )A.5种 B.4种 C.3种 D.2种
难度: 中等查看答案及解析
-
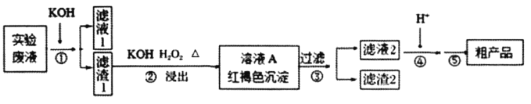
工业用强氧化剂PbO2来制备KClO4的工业流程如下:
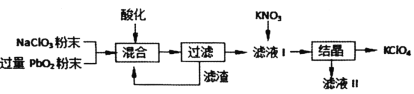
根据流程推测,下列判断不正确的是( )
A.“酸化”的试剂是稀硝酸或浓盐酸
B.“滤渣”主要成分是PbO2粉末,可循环使用
C.NaClO3与PbO2反应的离子方程式为
D.在KNO3、KClO4、NaClO4、NaNO3中,常温下溶解度小的是KClO4
难度: 中等查看答案及解析
-
全钒液流电池是一种以钒为活性物质呈循环流动液态的氧化还原电池。钒电池电能以化学能的方式存储在不同价态钒离子的硫酸电解液中,通过外接泵把电解液压入电池堆体内,在机械动力作用下,使其在不同的储液罐和半电池的闭合回路中循环流动,采用质子交换膜作为电池组的隔膜,电解质溶液流过电极表面并发生电化学反应,进行充电和放电。下图为全钒液流电池放电示意图:
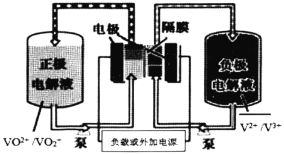
下列说法正确的是( )
A.放电时正极反应为:
B.充电时阴极反应为:
C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D.该电池的储能容量,可以通过增大电解液存储罐的容积并增加电解液的体积来实现
难度: 中等查看答案及解析
-
以0.10mol/L的氢氧化钠溶液滴定同浓度某一元酸HA的滴定曲线如图所示(
)。下列表述错误的是( )
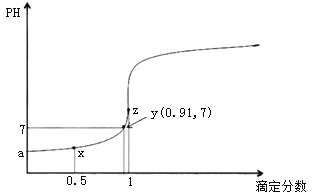
A.z点后存在某点,溶液中的水的电离程度和y点的相同
B.a约为3.5
C.z点处,
D.x点处的溶液中离子满足:
难度: 困难查看答案及解析