-
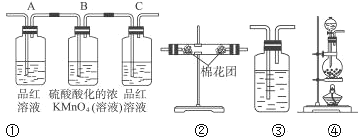
下列实验能证明一定有二氧化硫存在的是( )
①能使澄清石灰水变浑浊 ②能使湿润的蓝色石蕊试纸变红 ③能使品红溶液退色 ④通入足量的氢氧化钠溶液中,再加BaCl2溶液有白色沉淀产生,该沉淀溶于稀盐酸 ⑤通入溴水中能使溴水退色,再滴加Ba(NO3)2溶液有白色沉淀产生
A.都能 B.都不能 C.③④⑤ D.只有⑤
难度: 困难查看答案及解析
-
下图分别表示四种操作,其中有两处错误的是
A.读数
 B.稀释
B.稀释
C.溶解
 D.称量
D.称量 
难度: 简单查看答案及解析
-
下列说法中,正确的是 ( )
A.分离水和CCl4的混合物,必须用蒸馏法
B.从Na2CO3溶液中得到Na2CO3,可用过滤法
C.分离NaCl和AgCl的混合物,可用萃取法
D.从I2的CCl4溶液中得到CCl4,可用蒸馏法
难度: 简单查看答案及解析
-
下图所示是对Na2CO3、Na2SO4、K2CO3、K2SO4四种物质进行的分类,这种分类方法的名称是( )
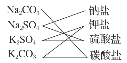
A.圈图法
B.链状箭头法
C.交叉分类法
D.树状分类法
难度: 简单查看答案及解析
-
类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是
已知
类推
A
将Fe加入CuSO4溶液中:Fe+Cu2+=Cu+Fe2+
将Na加入到CuSO4溶液中:2Na+Cu2+=Cu+2Na+
B
向稀硫酸加入NaOH溶液至中性:H++OH-=H2O
向H2SO4溶液加入Ba(OH)2溶液至中性:H++OH-=H2O
C
向氯化铝溶液中加入足量NaOH溶液:Al3++4OH-=AlO2-+2H2O
向氯化铝溶液中加入足量氨水:Al3++4NH3·H2O=AlO2-+2H2O+4NH4+
D
向Ca(OH)2溶液中通入过量CO2:CO2+OH-=HCO3-
向Ca(OH)2溶液中通入过量SO2:SO2+OH-=HSO3-
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可以通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是( )
A.KClO3在反应中失去电子 B.此反应中每生成1 mol ClO2转移的电子数为1 mol
C.ClO2是氧化产物 D.H2C2O4在反应中被还原
难度: 中等查看答案及解析
-
金属及其化合物转化关系是化学学习的重要内容之一。下列各组物质的转化关系中不全部是通过一步反应完成的是( )
A.Al→Al2O3→Al(OH)3→AlCl3 B.Na→NaOH→Na2CO3→NaCl
C.Mg→MgCl2→Mg(OH)2→MgSO4 D.Fe→FeCl2→Fe(OH)2→Fe(OH)3
难度: 中等查看答案及解析
-
下列实验方案可以得到白色纯净的Fe(OH)2的是( )
A.在Fe2(SO4)3溶液中加入过量的铁粉,过滤,在滤液中加入过量的NaOH溶液
B.用铁粉与稀硫酸充分反应,然后再加入过量的氨水
C.在FeCl2溶液上加一层苯,然后将滴管插入到FeCl2溶液液面以下,慢慢滴加NaOH溶液(溶液中不能有气泡,配制FeCl2和NaOH溶液的蒸馏水必须加热煮沸)
D.在生成Fe(OH)3的悬浊液中加过量的铁粉
难度: 中等查看答案及解析
-
一定量的SO2与NaOH溶液反应,所得产物中含有Na2SO3和NaHSO3,物质的量之比为2∶3,则参加反应的SO2与NaOH的物质的量之比为( )
A.1∶2 B.3∶5 C.5∶7 D.8∶11
难度: 中等查看答案及解析
-
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
选项
陈述Ⅰ
陈述Ⅱ
A
Fe3+有氧化性
FeCl3溶液可用于回收废旧电路板中的铜
B
SiO2有导电性
SiO2可用于制备光导纤维
C
SO2有漂白性
SO2可使溴水褪色
D
浓硫酸有强氧化性
浓硫酸可用于干燥H2和CO
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
以下五种有色溶液与SO2作用,能褪色且其实质相同的是( )
①滴有石蕊的NaOH溶液 ②氯水 ③酸性KMnO4溶液 ④品红溶液 ⑤碘和淀粉的混合物
A.①④ B.①②③ C.②③④ D.②③⑤
难度: 简单查看答案及解析
-
将SO2通入略显酸性的Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入BaCl2溶液,则会产生白色沉淀,在上述一系列变化过程中,最终被还原的微粒是
A.NO3- B.SO2 C.Fe2+ D.Fe3+
难度: 困难查看答案及解析
-
铜粉放入稀硫酸溶液中,加热后无明显现象发生。当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出。该盐是( )
A.FeSO4 B.Fe2(SO4)3 C.Na2CO3 D.KNO3
难度: 中等查看答案及解析
-
氨溶于水得到氨水,氯气溶于水得到氯水,下列关于新制的氨水、氯水的描述中正确的是 ( )
A.“两水”都是混合物,溶液中含有的粒子种类数目相同
B.“两水”中都存在可逆反应
C.“两水”都有刺激性气味,都能漂白有机色素
D.“两水”放置时间较久后都会因为相同的原理而变质
难度: 中等查看答案及解析
-
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如图所示,
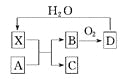
其中反应条件及部分产物均已略去,则下列有关说法正确的是
A.X使蔗糖变黑的现象主要体现了X的强氧化性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,最后有白色沉淀产生
D.工业上,B转化为D的反应条件为加热、使用催化剂
难度: 简单查看答案及解析
-
在实验室里可按如图所示装置干燥并收集气体R,且吸收多余的R气,则R是( )
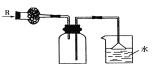
A.NH3 B.HCl C.NO D.CH4
难度: 简单查看答案及解析
-
无色的混合气体甲中可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过如图所示实验处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成可能为( )
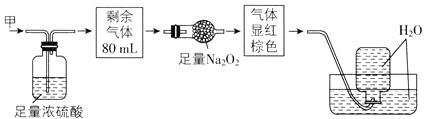
A.NO2、NH3、N2 B.NH3、NO、CO2
C.NH3、NO2、CO2 D.NO、CO2、N2
难度: 中等查看答案及解析
-
同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3 ②NO2③HCl和N2 的4:5混合气体,进行喷泉实验。经充分反应后,瓶内溶液的物质的量浓度为
A.①>②>③ B.①<②<③ C.①=②=③ D.①<②=③
难度: 困难查看答案及解析
-
将等体积的NO2和He的混合气体置于试管中,并将试管倒立于水槽中,充分反应后,剩余气体体积约为原总体积的
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下面是实验室制取氨气的装置和选用的试剂,其中错误的是( )
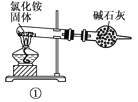
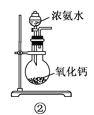
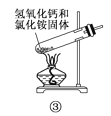
A. ①③ B. ②③
C. ①④ D. ②④
难度: 中等查看答案及解析
-
将3. 84 g铜粉与一定质量浓硝酸反应,当铜完全作用时,溶液中的NO3-减少0.1mol,则所消耗硝酸的物质的量是
A.0.1 mol B.0.11 mol C.0.16 mol D.0.22 mol
难度: 困难查看答案及解析
-
取三张蓝色石蕊试纸放在玻璃片上,然后按顺序分别滴加65%的HNO3、98%的H2SO4和新制的氯水,三张试纸呈现的颜色分别是( )
A.白、黑、红 B.红、黑、白 C.红、红、红 D.白、黑、白
难度: 中等查看答案及解析
-
右图的装置中,干燥烧瓶内盛有某种气体,烧杯和滴定管内盛放某种液体。挤压滴管的胶头,下列与实验事实不相符的是( )

A.CO2(NaHCO3溶液)/无色喷泉 B.NH3(H2O含酚酞)/红色喷泉
C.H2S(CuSO4溶液)/黑色喷泉 D.HCl(AgNO3溶液)/白色喷泉
难度: 中等查看答案及解析
-
检验试管中盛有的少量白色固体是铵盐的方法是
A.将固体加热,用湿润的红色石蕊试纸在试管口检验,看是否变蓝
B.加水溶解,用pH试纸测溶液的酸碱性
C.加入NaOH溶液,加热,再滴入酚酞试液
D.加入NaOH溶液,加热,用湿润的红色石蕊试纸在试管口检验,看是否变蓝
难度: 困难查看答案及解析
-
为了避免NO、NO2、N2O4对大气的污染,常采用NaOH溶液进行吸收处理(反应方程式:2NO2+2NaOH=NaNO3+NaNO2+H2O;NO2+NO+2NaOH=2NaNO2+H2O)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L NaOH溶液吸收(无气体剩余),则此NaOH溶液的物质的量浓度为( )
A.
mol·L-1 B.
mol·L-1
C.
mol·L-1 D.
mol·L-1
难度: 中等查看答案及解析