-
化学平衡常数(K) 、电离常数(Ka、Kb) 、溶度积常数(Ksp) 等是表示、判断物质性质的重要常数。下列关于这些常数的说法中,正确的是( )
A. Ka (H2CO3) a (CH3COOH) 说明相同物质的量浓度时,碳酸的酸性比醋酸的强
B. 在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp (AgCl) 增大
C. 一般情况下,当温度 升高 时,弱酸、弱碱的电离 常数(Ka、Kb ) 均变 大
D. 化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
难度: 中等查看答案及解析
-
同周期的三种元素X、Y、Z,已知其最高价氧化物对应水化物的酸性强弱为HXO4>H2YO4>H3ZO4,则下列判断错误的是
A. 原子半径:X>Y>Z
B. 气态氢化物的稳定性HX>H2Y>ZH3
C. 电负性:X>Y>Z
D. 非金属性:X>Y>Z
难度: 中等查看答案及解析
-
在4NH3+5O2⇌4NO+6H2O反应中,表示该反应速率最快的是
A. υ(NH3)=0.8mol/(L•s) B. υ(O2)=1.0mol/(L•s)
C. υ(NO)=1.0mol/(L•s) D. υ(H2O)=1.8mol/(L•s)
难度: 简单查看答案及解析
-
已知:2Zn(s)+O2(g)=2ZnO(s)△H= —701.0kJ·mol-1 ,2Hg(l)+O2(g)=2HgO(s)△H= —181.6kJ·mol-1,则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为( )
A. -259.7 kJ·mol-1 B. +259.7 kJ·mol-1 C. +519.4kJ·mol-1 D. -519.4kJ·mol-1
难度: 中等查看答案及解析
-
一定条件下反应2AB(g)⇌A2(g)+B2(g)达到平衡状态的标志是
A.单位时间内生成3n molA2,同时消耗2n molAB
B.容器内,3种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的物质的量分数不随时间变化
难度: 简单查看答案及解析
-
用标准的盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是( )
A. 用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
B. 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定
C. 用碱式滴定管取10.00 mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定
D. 用酚酞作指示剂滴至红色刚变无色时即停止加盐酸
难度: 简单查看答案及解析
-
构造原理揭示的电子排布能级顺序,实质是各能级能量高低,若以E表示某能级的能量,下列能量大小顺序中正确的是
A.E(4s)>E(3p)>E(3d) B.E(3s)>E(3p)>E(3d)
C.E(6s)>E(4f)>E(5d) D.E(5s)>E(4p)>E(3d)
难度: 中等查看答案及解析
-
下列各基态原子或离子的电子排布式正确的是
A.O2﹣1s22s22p4 B.Ca 3d2
C.Fe 3d54s3 D.Si 1s22s22p63s23p2
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A. K+的结构示意图:
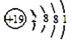
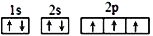
B. 基态氮原子的电子排布图:
C. 水的电子式:
D. 基态铬原子(24Cr)的价电子排布式:3d44s2
难度: 简单查看答案及解析
-
下列说法错误的是
A.电子排布式1s22s22p63s23p64s3违反了泡利原理
B.基态原子电子排布式1s22s22p63s23p63d5违反了能量最低原理
C.根据构造原理,原子核外电子填充顺序为1s2s2p3s3p3d 4s4p……
D.某主族元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、…,当它与氯气反应时生成的阳离子是X2+
难度: 中等查看答案及解析
-
下列原子的价电子排布中,对应元素第一电离能最大的是( )
A. 3s23p1 B. 3s23p2 C. 3s23p3 D. 3s23p4
难度: 简单查看答案及解析
-
已知下列元素原子的最外层电子排布式,其中不一定能表示该元素为主族元素的是
A. 3s23p3 B. 4s2 C. 4s24p1 D. 3s23p5
难度: 中等查看答案及解析
-
周期表中有如图所示的元素,下列叙述正确的是( )
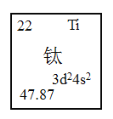
A.钛元素原子的M层上共有10个电子
B.钛元素是ds区的过渡元素
C.钛元素原子最外层上有4个电子
D.47.87是钛原子的近似相对原子质量
难度: 简单查看答案及解析
-
下列各组元素性质的递变情况错误的是
A.Na、Mg、Al原子最外层电子数依次增多
B.P、S、Cl元素最高正价依次升高
C.N、O、F第一电离能依次增大
D.Na、K、Rb电负性逐渐减小
难度: 中等查看答案及解析
-
在密闭容器中A与B反应生成C,其反应速率分别用v(A),v(B),v(C)表示,已知v(A),v(B),v(C)之间有以下关系3v(A)=2v(B),3v(C)=2v(B),则此反应可表示为( )
A.2A+3B=2C B.A+3B=2C C.3A+B=2C D.A+B=C
难度: 简单查看答案及解析
-
改变下列条件,一定能加快反应速率的是
A.增加反应物的量 B.增大压强 C.加热 D.加酶
难度: 简单查看答案及解析
-
反应N2(g)+3H2(g)
2NH3 (g) △H<0,在某一时间段中反应速率与反应过程的曲线关系如图,t1、t3、t4时刻外界条件有所改变。下列说法正确的是( )

A.t5~t6时氨气的体积分数最大 B.t3时升高了温度
C.t1时加入催化剂 D.t4时减小压强
难度: 中等查看答案及解析
-
下列能用勒沙特列原理解释的是
A.Fe(SCN)3溶液中加入固体KSCN后颜色变深
B.棕红色Br2蒸气加压后颜色变深
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡混和气加压后颜色变深
难度: 简单查看答案及解析
-
下列各选项与盐类的水解无关的是
A.纯碱去油污 B.明矾净水
C.泡沫灭火器的工作原理 D.碳酸钙粉末溶于醋酸
难度: 简单查看答案及解析
-
下列反应中,既属于氧化还原反应又属于吸热反应的是
①Ba(OH)2·8H2O与NH4Cl反应 ②灼热的炭与CO2反应 ③铝与稀盐酸 ④铝粉与氧化铁粉末反应 ⑤H2在Cl2中燃烧 ⑥弱酸电离
A.①⑥ B.②③ C.② D.④⑤
难度: 简单查看答案及解析
-
常温下0.1mol/L 的CH3COOH溶液加水稀释过程中,下列数值一定变小的是
A.c(H+) B.c (H+) /c(CH3COOH)
C.c (H+)·c(OH-) D.c(OH-)/c (H+)
难度: 简单查看答案及解析
-
白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P=O ckJ·mol—1、O=O dkJ·mol—1。
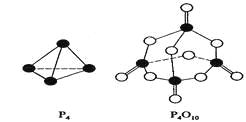
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A. (6a+5d-4c-12b)kJ·mol—1
B. (4c+12b-6a-5d)kJ·mol—1
C. (4c+12b-4a-5d)kJ·mol—1
D. (4a+5d-4c-12b)kJ·mol—1
难度: 中等查看答案及解析
-
下列各物质对水的电离不会产生影响的是
A.氯化钠 B.氯化铵 C.氯化铁 D.氯化氢
难度: 简单查看答案及解析
-
下列无法证明某酸HA是弱酸的实验方案是( )
A.室温下,测得0.1mol·L-1HA溶液的pH>1,证明HA是弱酸
B.碳酸钠溶液中滴入0.1mol·L-1的HA溶液,产生大量无色气体
C.室温下测得某HA溶液的pH=a,用蒸馏水稀释100倍测得溶液pH=b,且b-a<2
D.室温下,用pH试纸测得0.1mol·L-1 NaA溶液的pH>7
难度: 中等查看答案及解析
-
常温下,取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH 等于12,则原溶液的浓度为
A.0.01mol•L-1 B.0.17mol•L-1 C.0.05mol•L-1 D.0.50mol•L-1
难度: 简单查看答案及解析
-
关于下列各装置图的叙述中,不正确的是

A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
难度: 中等查看答案及解析
-
常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )
序号
①
②
③
④
溶液
CH3COONa
NaHCO3
Na2CO3
NaClO
pH
8.8
9.7
11.6
10.3
A.等浓度的CH3COOH 和HClO溶液,pH小的是HClO
B.Na2CO3和NaHCO3溶液中粒子种类不同
C.溶液水的电离程度:①>②>④>③
D.NaHCO3溶液中:c (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)
难度: 中等查看答案及解析
-
将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图(不考虑电极产物的溶解),则下列说法正确的是( )
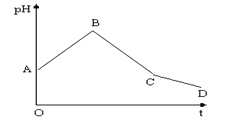
A.阳极产物一定是Cl2,阴极产物一定是Cu
B.整个过程中阳极先产生Cl2,后产生O2
C.BC段表示在阴极上是H+放电产生了H2
D.CD段表示阳极上OH-放电破坏了水的电离平衡,产生了H+
难度: 中等查看答案及解析
-
如图所示,甲池的总反应式为:
,下列关于该电池工作时的说法正确的是
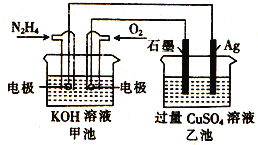
A.该装置工作时,Ag电极上有气体生成
B.甲池中负极反应为
C.甲池和乙池中的溶液的pH均减小
D.当甲池中消耗
时,乙池中理论上最多产生
固体
难度: 中等查看答案及解析
-
常温下,向20mL0.1mol/L氨水中逐滴加入0.1mol/L盐酸,测得溶液的pH随加入盐酸的体积变化如图所示。下列说法正确的是( )
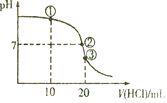
A.①溶液中:c(Cl-)=2c(NH4+)+2c(NH3·H2O)
B.②溶液中:c(NH4+)= c(Cl-)= c(OH-)= c(H+)
C.③溶液中:c(H+)= c(OH-)+ c(NH4+)+c(NH3·H2O)
D.滴定过程中可能出现:c(NH3·H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
难度: 简单查看答案及解析