-
化学与科学、技术、社会、环境关系密切,下列说法不正确的是
A. 海水淡化的方法有蒸馏法、离子交换法、电渗析法等
B. NH4Cl和ZnCl2溶液可用作焊接钢铁时的除锈剂
C. 用牺牲镁块的方法防止地下钢铁管道的腐蚀
D. 电解熔融氧化镁可以得到镁,电解熔融氯化镁不能得到镁
难度: 简单查看答案及解析
-
下列说法正确的是
A.甲烷的燃烧热为ΔH=-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1
B.已知H2O(1)=H2O(g) ΔH=+44kJ·mol-1,则2g H2(g)完全燃烧生成液态水比生成气态水多释放22kJ的能量
C.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH<0
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的ΔH相同
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数,下列说法不正确的是
A.500mL2mol/L葡萄糖溶液中所含分子总数是NA
B.1L0.1mol/LNa2CO3溶液中的阴离子总数大于0.1NA
C.1molNa2O和Na2O2固体混合物中含有的阴、阳离子总数是3NA
D.1L2mol/L的氯化铁溶液完全制成胶体,氢氧化铁胶体的粒子数小于2NA
难度: 简单查看答案及解析
-
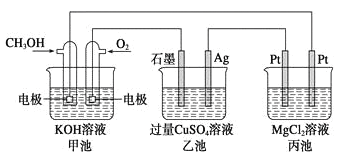
某兴趣小组设计了如图所示原电池装置(盐桥中吸附有K2SO4饱和溶液)。下列说法正确的是()
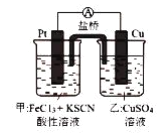
A.该原电池的正极反应是Cu2++2e-=Cu
B.甲烧杯中溶液的血红色逐渐变浅
C.盐桥中的SO42-流向甲烧杯
D.若将甲烧杯中的溶液换成稀硝酸,电流表指针反向偏转
难度: 中等查看答案及解析
-
已知某水溶液中大量存在H+、Mg2+、K+、NO3-、Cl-中的四种离子,且存在的各离子具有相同的物质的量,则不能存在的离子是( )
A.H+ B.Mg2+ C.Cl- D.NO3-
难度: 中等查看答案及解析
-
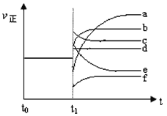
下列图示与对应的叙述相符的是
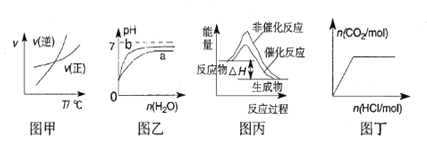
A.由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0
B.图乙表示pH相同的盐酸与氢氟酸分别加水稀释PH的变化,其中曲线a对应的是氢氟酸
C.图丙表示该反应为放热反应,且催化剂能改变反应的焓变
D.图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系
难度: 中等查看答案及解析
-
用惰性电极分别电解下列各物质的水溶液,一段时间后,向剩余电解质溶液中加入适量相应的溶质能使溶液恢复到电解前浓度的是
A.AgNO3 B.Na2SO4 C.CuCl2 D.KCl
难度: 简单查看答案及解析
-
下列与金属腐蚀有关的说法正确的是( )
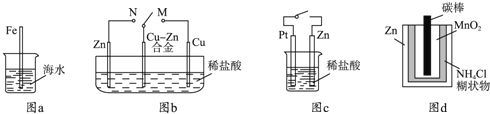
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu﹣Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
难度: 中等查看答案及解析
-
解释下列事实的方程式不正确的是
A.NaHCO3溶液显碱性原因: HCO3-+H2O=H3O++CO32-
B.用FeCl3溶液腐蚀印刷电路板上的铜:2Fe3++Cu=2Fe2++Cu2+
C.盛装NaOH溶液试剂瓶不能用玻璃塞:2OH-+SiO2=SiO32-+H2O
D.自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶的方铅矿(PbS),慢慢转变为铜蓝(CuS): CuSO4+PbS=CuS+PbSO4
难度: 中等查看答案及解析
-
室温下,已知Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=5.0×10-9。下列说法中正确的是
A.在含有BaSO4固体的溶液中,一定有c(Ba2+)=c(SO42-)
B.向只含有BaSO4的悬独液中加入少量水,溶液中c(Ba2+)增大
C.若BaSO4悬浊液中逐渐加入Na2CO3固体至c(CO32-)=5.0×10-4mol/L时,BaSO4开始向BaCO3沉淀转化
D.往Na2CO3和Na2SO4的混合溶液中加入BaCl2溶液,当生成BaCO3沉淀时,(CO32-)/ c(SO42-)=0.02
难度: 困难查看答案及解析
-
下列反应常温时能自发进行,既能用焓判据又能用熵判据解释的是
A.HCl+NH3=NH4Cl B.2Na2O2+2H20=4NaOH+O2↑
C.2KClO3=2KCl+302↑ D.Ba(OH)2•8H20+2NH4Cl=BaCl2+2NH3↑+10H2O
难度: 简单查看答案及解析
-
向体积为0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是
A. Va>Vb时:c(CH3COOH) +c(CH3COO-)>c(K+)
B. Va=Vb时:c(CH3COOH) +c(H+)=c(OH-)
C. Va<Vb时:c(CH3COO-)> (K+)>c(OH-)> c(H+)
D. Va与Vb任意比时:c(K+)+ c(H+) = c(OH-)+ c(CH3COO-)
难度: 中等查看答案及解析
-
下列说法中不正确的有( )
①水是一种极弱的电解质,在常温下平均每n个水分子只有1个分子发生电离,n的值是55.6×107
②两种醋酸的物质的量浓度分别为c1和c2, pH分别为a和a+1,则c1=10c2
③常温下pH=4的醋酸加水稀释过程中,所有离子浓度都降低
④蒸干AlCl3溶液可得纯净的无水氯化铝
⑤常温下,等体积的pH=12的碱甲溶液和pH=11的碱乙溶液,分别用等浓度的盐酸中和时,消耗盐酸的体积为2V甲=V乙,则乙一定是弱碱
A.1个 B.2个 C.3个 D.4个
难度: 中等查看答案及解析
-
在恒温、恒容密闭容器中发生反应:A(s) +2B(g)
C(g)+D(g),当下列物理量不再发生变化时,表明该反应已达到平衡状态的是( )
①混合气体的压强 ②混合气体的密度 ③各气态物质的物质的量浓度 ④气体的总物质的量 ⑤混合气体的平均相对分子质量
A.②③⑤ B.①②③ C.①②③⑤ D.①③④⑤
难度: 中等查看答案及解析
-
反应mA(s)+nB(g)
pC(g) △H>O,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定不正确的是
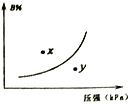
① m+n>p ②x点表示的正反应速率小于逆反应速率 ③n<p
④反应速率x点比y点时的慢 ⑤若升高温度,该反应的平衡常数减小
A. ②⑤ B. ②④ C. ①③ D. ①③⑤
难度: 中等查看答案及解析
-
室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是
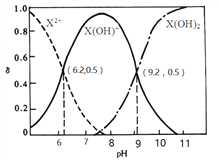
A.Kb2的数量级为10-8
B.X(OH)NO3水溶液显碱性
C.等物质的量的X(NO3)2和X(OH)NO3混合溶液中 c(X2+)>c[X(OH)+]
D.在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)= c(X2+)+ c(H+)
难度: 中等查看答案及解析