-
生活或实验中常碰到一些化学知识,下列分析中不正确的是
A. 人体不能缺碘,需要正常补碘,“加碘食盐”中的“碘”是指碘元素
B. 进行焰色反应实验时,蘸取样品之前需要用稀硫酸溶液清洗铂丝
C. “绿色化学”的理想在于不再使用有毒、有害的物质,不再产生废物
D. 水壶中产生的水垢(主要成分为CaCO3和Mg(OH)2)可用食醋清洗除去
难度: 简单查看答案及解析
-
磁流体是电子材料的新秀,它是由直径为纳米量级(1到10 nm之间)的磁性固体颗粒、基载液以及界面活性剂三者混合而成的分散系,既具有固体的磁性,又具有液体的流动性,下列关于纳米Fe3O4磁流体的说法中不正确的是( )
A. 纳米Fe3O4磁流体分散系属于溶液
B. 纳米Fe3O4磁流体可以通过半透膜得到提纯
C. 当一束可见光通过该磁流体时会出现光亮的通路
D. 纳米Fe3O4磁流体比较稳定
难度: 中等查看答案及解析
-
我国稀土资源丰富。下列有关稀土元素
与
的说法正确的是( )
A.
与
的质量数相同
B.
与
是同一种核素
C.
与
互为同位素
D.
与
的核外电子数和中子数均为62
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.常温常压下,1.06g Na2CO3含有的Na+离子数为0.01NA
B.标准状况下,22.4L酒精含有的分子数为NA
C.在常温常压下,28gN2与CO混合物气体中所含的分子数目一定为NA
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA
难度: 中等查看答案及解析
-
为了除去粗盐中的Ca2+,Mg2+,SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序:①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液
A.②⑤④①③ B.④①②⑤③
C.④②⑤①③ D.①④②⑤③
难度: 中等查看答案及解析
-
用0.1mol/LNa2SO3溶液20mL,恰好将1.0×10-3molXO4-还原,则X元素在反应后所得还原产物中化合价为
A.+3价 B.+2价 C.+1价 D.0价
难度: 中等查看答案及解析
-
下列各组离子,在溶液中能大量共存、加入足量 NaOH 溶液后加热既有气体放出又有沉淀生成的一组 是( )
A.Ba2+、NO3﹣、NH4+、Cl﹣
B.Ca2+、HCO3﹣,NH4+、CO32﹣
C.K+、Ba2+、Cl﹣、HCO3﹣
D.Mg2+、NH4+、SO42﹣、K+
难度: 中等查看答案及解析
-
200mL Fe2(SO4)3溶液中含Fe3+56g,在该溶液中加入1mol/LBaCl2溶液300mL,反应后溶液中SO42-的物质的量浓度是(忽略混合后溶液的体积变化) ( )
A.7.5mol/L B.5mol/L C.6mol/L D.2.4mol/L
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.相同温度下,Na2CO3比NaHCO3的溶解度小
B.只有钠单质和钠盐的焰色反应呈现黄色
C.可用石灰水区分Na2CO3与NaHCO3 溶液
D.在Na2O2中阳离子与阴离子的个数比为2:1
难度: 中等查看答案及解析
-
下列离子检验的结论正确的是( )
A.向含有 Fe2+溶液中加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有还原性
B.某溶液与NaOH溶液共热,产生了使湿润的蓝色石蕊试纸变红的气体,说明原溶液中一定存在NH4+
C.某固体中加入稀盐酸,产生了无色无味的气体,则该固体中一定含有CO32-
D.向无色溶液中加BaC12溶液,生成了白色沉淀,再加稀硝酸,沉淀不消失,由此可确定该溶液中一定含有 SO42-
难度: 中等查看答案及解析
-
下列有关说法正确的是
A. 1L水中溶解了40.0 g NaOH,该溶液的物质的量浓度为1 mol/L
B. 从1L2mol/L的NaCl液中取出0.5L,取出的该溶液的浓度为1mol/L
C. 中和100 mL 1mol/L的H2SO4溶液,需NaOH8.0g
D. 配制500mL0.5mol/L的CuSO4溶液,需40.0g胆矾
难度: 中等查看答案及解析
-
氰[(CN)2]的化学性质与卤素(X2)很相似,化学上称之为拟卤素,其氧化性介于Br2和I2之间,下列有关反应方程式不正确的是
A. (CN)2和NaOH溶液反应:(CN)2+2OH-=CN-+CNO-+H2O
B. MnO2和HCN反应:MnO2+4HCN(浓)
Mn(CN)2+(CN)2↑+2H2O
C. 在NaBr和KCN混合溶液中通入少量Cl2:Cl2+2CN-=2Cl-+(CN)2
D. 向KCN溶液中加入碘水:I2+2KCN=2KI+(CN)2
难度: 简单查看答案及解析
-
下列化学反应的离子方程式中正确的是( )
A.盐酸与碳酸钙反应:CO32-+2H+=CO2↑+H2O
B.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3- =CaCO3↓+H2O
C.氯气溶于水:Cl2+H2O
2H++Cl-+ClO-
D.Ba(OH)2与稀H2SO4反应的离子方程式:H++OH-=H2O
难度: 中等查看答案及解析
-
向
、
、
混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成不可能是
A.
B.
C.
、
、
D.
难度: 中等查看答案及解析
-
将一块金属钠露置于空气中,观察到下列现象:金属钠银白色
变灰暗
变白色
表面潮湿
形成白色晶体
形成白色粉末。据此判断下列说法中不正确的是( )
A.过程⑤最终形成的白色粉末是
B.过程④是氢氧化钠溶液吸收空气中的
、水蒸气形成了碳酸氢钠晶体
C.过程③中,是因为氢氧化钠具有很强吸湿性,吸收空气中的水分子,最后会完全溶解成溶液
D.整个变化过程中只有一个氧化还原反应
难度: 中等查看答案及解析
-
只用溴水就可以将下列物质鉴别出来的是
A.水、CCl4、酒精、苯
B.NaCl溶液、NaBr溶液、NaI溶液、NaOH溶液
C.AgNO3溶液、NaOH溶液、KI溶液、CCl4
D.CCl4、酒精、NaCl溶液、KI-淀粉溶液
难度: 中等查看答案及解析
-
将NO3-+Zn+OH-+H2O → NH3+Zn(OH)42- 配平后,离子方程式中H2O的系数是
A.2 B.4 C.6 D.8
难度: 中等查看答案及解析
-
如果ag某气体中含有的分子数为b,则cg该气体的物质的量为(设阿伏加德罗常数为NA)
A. bc/aNA mol B. ac/bNA mol C. ab/cNA mol D. b/acNA mol
难度: 中等查看答案及解析
-
某溶液中只含有下列四种离子Fe3+、SO42-、Cl-和M离子,经测定Fe3+、SO42-、Cl-和M离子的物质的量之比为2:4:4:3,则M离子可能是下列中的( )
A.Mg2+ B.CO32- C.Ba2+ D.Na+
难度: 简单查看答案及解析
-
已知一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3
2HNO3+4N2↑+9H2O,下列说法正确的是( )
A. 分解反应都是氧化还原反应 B. N2是还原产物,HNO3是氧化产物
C. 被氧化与被还原的氮原子数之比为3∶5 D. 每生成4mol N2转移15mol电子
难度: 中等查看答案及解析
-
Na2FeO4是一种高效多功能水处理剂,应用前景十分看好.一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是( )
A.Na2FeO4是还原产物
B.Na2O2既是氧化剂又是还原剂
C.若有2molFeSO4参与反应,则该反应中共有8mol电子转移
D.Na2O2与水反应生成NaOH和氧气,所以Na2O2是碱性氧化物
难度: 中等查看答案及解析
-
如图为从海带中提取碘的工业生产过程,有关说法错误的是( )
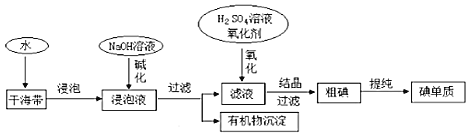
A.在实验室进行氧化操作时,加入的氧化剂可以是新制氯水、双氧水等
B.碱化操作时,加入NaOH溶液的原因是在碱性溶液中,可溶性有机质可形成沉淀
C.因海水中蕴藏着极其丰富的碘元素,所以工业上也可以直接用海水来提取碘
D.在实验室进行过滤操作时,需要用到玻璃仪器有玻璃棒、烧杯、漏斗
难度: 中等查看答案及解析
-
将一定量的Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到a L混合气体。将该混合气体通过电火花引燃,恰好完全反应,则原混合物中Na、Na2O、Na2O2的物质的量之比可能为( )
A. 2:1:2 B. 1:1:2 C. 2:2:1 D. 1:1:1
难度: 中等查看答案及解析
-
现有一混合物的水溶液,可能含有以下离子中的几种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-现取三份各100mL溶液进行如下实验: 第一份加入AgNO3溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到0.08mol气体;第三份加足量BaCl2溶液后,得到干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。正确的是
A.该混合液中一定含有:K+、NH4+、CO32-、SO42-,可能含Cl-,且n(K+)≥0.04mol
B.该混合液中一定含有:NH4+、CO32-、SO42-,可能含K+、Cl-
C.该混合液中一定含有:NH4+、CO32-、SO42-,可能含Mg2+、K+、Cl-
D.该混合液中一定含有:NH4+、SO42-,可能含Mg2+、K+、Cl-
难度: 困难查看答案及解析