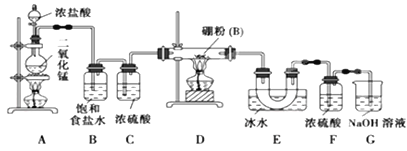
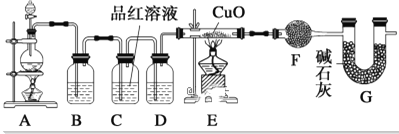
-
已知以下三个实验均能发生化学反应:①将铁钉放入硫酸铜溶液中;②向硫酸亚铁溶液中滴入几滴氯水;③将铜丝放入氯化铁溶液中。下列判断正确的是( )
A. 实验①中铁钉只做还原剂 B. 实验②中Fe2+既显氧化性又显还原性
C. 实验③中发生的是置换反应 D. 上述实验证明氧化性:Fe3+>Fe2+>Cu2+
难度: 困难查看答案及解析
-
黑火药爆炸时发生的反应为:S + 2KNO3 + 3C = K2S + N2↑+3CO2↑,下列说法错误的是( )
A. C在反应中作氧化剂 B. S和KNO3都发生了还原反应
C. CO2是氧化反应的产物 D. K2S和N2都是还原反应的产物
难度: 中等查看答案及解析
-
化学与科学、技术、社会、环境密切相关,下列有关说法中错误的是
A. 常温下可用铁或铝制容器盛装浓硫酸
B. 小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂
C. 实验室可用石英坩埚熔融烧碱
D. 氧化铝是一种比较好的耐火材料,可用来制造耐火坩埚
难度: 简单查看答案及解析
-
中国科学家屠呦呦因开创性地运用萃取的原理从中草药中分离出青蒿素并应用于疟疾治疗获得今年的诺贝尔医学奖。萃取实验中用到的主要仪器是 ( )
A. 长颈漏斗 B. 分液漏斗
C. 圆底烧瓶 D. 蒸馏烧瓶
难度: 中等查看答案及解析
-
现有Na2SO4、(NH4)2SO4、NaCl、NH4Cl四瓶无色溶液,能将其鉴别开来的试剂是
A.稀盐酸 B.BaCl2溶液 C.NaOH溶液 D.Ba(OH)2溶液
难度: 中等查看答案及解析
-
氯气是一种重要的工业原料,工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气,下列说法错误的是
A.若管道漏气遇氨就会产生白烟
B.该反应利用了Cl2的强氧化性
C.该反应NH3被还原
D.生成1 mol N2有6 mol电子转移
难度: 中等查看答案及解析
-
按纯净物、混合物、电解质顺序排列的一组物质是( )
A.盐酸、空气、醋酸 B.液氯、海水、硫酸钠晶体
C.铁粉、碘盐、氨水 D.胆矾、漂白粉、氯化钾溶液
难度: 简单查看答案及解析
-
氯水可用来杀菌消毒,又可作为漂白剂,其中起主要作用的物质是
A.Cl2 B.HC1O C.HC1 D.H2O
难度: 简单查看答案及解析
-
下列关于物质的检验说法不正确的是( )
A.加入氯化钡溶液有白色沉淀生成,再加稀硝酸沉淀不消失,一定含有
B.观察钾元素焰色反应的操作是:将铂丝用稀盐酸洗涤后灼烧至火焰为无色,然后再用铂丝蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察
C.待检液加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定含有
D.待检液加入氯化钡溶液有白色沉淀生成,再加入足量盐酸沉淀消失且产生无色无味的气体,则待检液中一定含有
难度: 中等查看答案及解析
-
在强碱性溶液中,下列离子组能大量共存的是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列离子方程式的书写中正确的是
A.氢氧化镁与盐酸反应:H++OH-=H2O
B.铁与盐酸反应:2Fe+6H+=2Fe3++3H2
C.氧化铝溶于稀硫酸:Al2O3+6H+=2Fe3++3H2O
D.向沸水中滴加FeCl3溶液制备Fe(OH)3 胶体:Fe3++3H2O=Fe(OH)3+3H+
难度: 中等查看答案及解析
-
高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
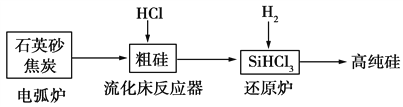
下列说法正确的是 ( )
A. 自然界中存在大量的单质硅
B. 步骤电弧炉中的化学方程式为SiO2+C
Si+CO2↑
C. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D. SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
①标准状况下,含NA个氩原子的氩气体积约为22.4 L
②在Fe参与的反应中,1mol Fe失去的电子数为3NA
③标准状况下,11.2L Cl2溶于水转移的电子总数为0.5NA
④1L.1 mol/L 的Fe(OH)3胶体中含有NA个Fe(OH)3胶粒
⑤常温常压下,21g氧气和27g臭氧中含有的氧原子总数为3NA
⑥物质的量浓度为0.5 mol·L-1的MgCl2溶液中,含有Cl-个数为NA
A.①⑤ B.①③⑥ C.②③⑤ D.①⑤⑥
难度: 中等查看答案及解析
-
下列关于钠及其化合物的叙述正确的是( )
①过氧化钠和氧化钠都能和酸反应,都是碱性氧化物。
②碳酸钠和碳酸氢钠两种盐,都既能跟盐酸又能跟氢氧化钠溶液反应。
③过氧化钠可做供氧剂,而氧化钠不能。
④常温切开一块金属钠,表面很快变暗,是因为钠和氧气反应生成了过氧化钠。
⑤向酚酞试液中加入过氧化钠,溶液先变红后退色,并有气泡产生。
⑥向硫酸铜溶液中分别加入过氧化钠和氧化钠,溶液中都会产生蓝色沉淀。
A.③⑤⑥ B.只有③④⑥ C.②③④⑤ D.①③⑤⑥
难度: 中等查看答案及解析
-
在标准状况下,将V L A气体(摩尔质量为M g·mol-1)溶于0.1 L水中,所得溶液密度为d g·mL-1,则此溶液的物质的量浓度为( )
A.
mol·L-1 B.
mol·L-1
C.
mol·L-1 D.
mol·L-1
难度: 中等查看答案及解析
-
已知 20mL R2O72- 离子浓度为 0.05mol·L-1 的某溶液恰好能将 20mL Fe2+离子浓度为 0.3mol·L-1 的溶液完全氧化,则元素R在还原产物中的化合价为( )
A.+2价 B.+3价 C.+4价 D.+5价
难度: 中等查看答案及解析