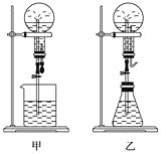
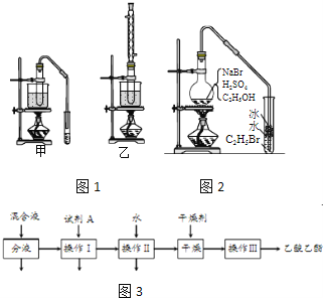
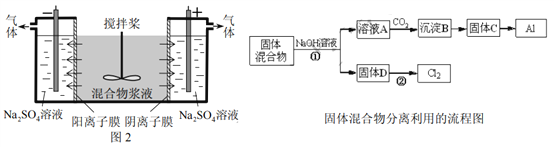
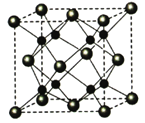
-
如表为某有机物与各种试剂的反应现象,则这种有机物可能是
试剂
钠
溴水
NaHCO3溶液
现象
放出气体
褪色
放出气体
A.CH2=CHCH2OH B.
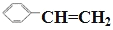
C.CH2=CHCOOH D.CH3COOH
难度: 简单查看答案及解析
-
海水是一个巨大的化学资源宝库。在开发利用海水资源过程中,下列说法不正确的是
A. 加入明矾,使海水的盐分沉淀并淡化
B. 海水蒸发制海盐的过程中只发生了物理变化
C. 海水淡化的方法主要有蒸馏法、离子交换法和电渗透法等
D. 大海中含有钾、溴、碘等元素,需经过氧化还原反应才可得到钾、溴、碘的单质
难度: 简单查看答案及解析
-
为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol 的
中,含有
个中子
B. pH=1的H3PO4溶液中,含有
个
C. 2.24L(标准状况)苯在O2中完全燃烧,得到
个CO2分子
D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加
个P-Cl键
难度: 困难查看答案及解析
-
过氧化钠具有强氧化性,遇木炭、铝粉等还原性物质时可燃烧。下列有关说法不正确的是( )
A.Na2O2与CO2反应时,Na2O2是氧化剂,CO2是还原剂
B.1mol过氧化钠中阴离子数目为NA
C.过氧化钠与木炭、铝粉反应时,过氧化钠均表现出强氧化性
D.过氧化钠与二氧化硫反应时可生成硫酸钠
难度: 简单查看答案及解析
-
研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是
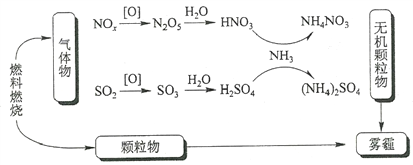
A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
难度: 简单查看答案及解析
-
全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是
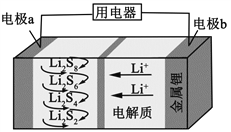
A.电池工作时,正极可发生反应:2Li2S6+2Li++2e−=3Li2S4
B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g
C.石墨烯的作用主要是提高电极a的导电性
D.电池充电时间越长,电池中Li2S2的量越多
难度: 困难查看答案及解析
-
对下列物质溶于水时破坏的作用力描述错误的是
A. 氯化钠,破坏了离子键 B. 氯化氢,破坏了共价键
C. 蔗糖,破坏了分子间作用力 D. 二氧化碳,没有破坏作用力
难度: 中等查看答案及解析
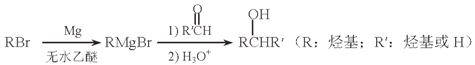
 所需醛的可能结构简式:_______________。
所需醛的可能结构简式:_______________。