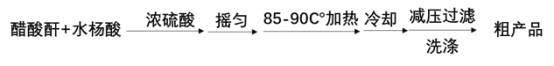-
化学与社会、生活密切相关。下列说法正确的是
A.棉花、羊毛、蚕丝和麻是天然纤维
B.蛋白质溶液中,加入浓的硫酸铵溶液有沉淀析出,加水后沉淀不溶解
C.油脂是单位质量内产生能量最高的营养物质,有共同的水解产物乙二醇
D.聚乳酸是一种可降解高分子材料,它是由单体之间通过加聚而合成的
难度: 简单查看答案及解析
-
下列由电子排布式或排布图所得的结论错误的是
选项
电子排布式或排布图
结论
A
1s22s22p63s23px2
违背洪特规则
B
1s22s22p63s23p63d3
违背能量最低原理
C
Ni原子的价电子排布图
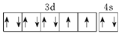
该原子处于基态
D
S原子的电子排布图
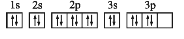
违背泡利原理
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
山萘酚结构简式如下图所示,且大量存在于水果、蔬菜、豆类、茶叶中,具有多种生物学作用,如抗氧化、抑制肿瘤生长及保护肝细胞等作用。下列有关山萘酚的叙述正确的是
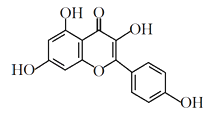
A.山萘酚含有苯环和羟基、醚键、羰基、碳碳双键五种官能团
B.可发生取代反应、水解反应、加成反应
C.可与NaOH反应,不能与NaHCO3反应
D.1 mol山萘酚与溴水反应最多可消耗4 mol Br2
难度: 中等查看答案及解析
-
聚乙炔衍生物分子M的结构简式及M在稀硫酸作用下的水解反应如图所示。下列有关说法不正确的是 ( )
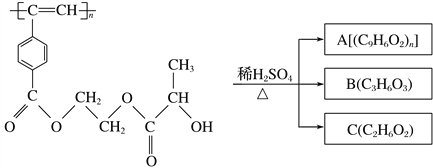
M
A.M与A均能使酸性高锰酸钾溶液和溴水褪色
B.B中含有羧基和羟基两种官能团,能发生消去反应和酯化反应
C.1 mol M与热的烧碱溶液反应,可消耗2n mol NaOH
D.A、B、C各1 mol分别与金属钠反应,放出气体的物质的量之比为1∶2∶2
难度: 中等查看答案及解析
-
铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。下列说法正确的是
A.Fe3+基态核外价电子排布式为[Ar]3d5
B.1 mol丙酮能与2mol Ag(NH3)2OH发生反应
C.C、H、O三种元素的原子半径按由小到大的顺序为H<C<O
D.乙醇中的羟基之间可以形成分子间氢键,故沸点高于丙酮
难度: 简单查看答案及解析
-
下列说法正确的是
A.最外层电子数为8的粒子都是稀有气体元素的原子
B.电子在1s轨道上运动像地球围绕着太阳旋转
C.任何原子里不存在运动状态完全相同的两个电子
D.电子仅由激发态跃迁到基态时才会产生原子光谱
难度: 简单查看答案及解析
-
下列关于原子核外电子排布与元素在周期表中位置关系的表述中,正确的是
A.最外层有三个未成对电子的原子一定为主族元素原子
B.基态原子的价电子排布为(n-1)dxnsy的元素的族序数一定为x+y
C.在元素周期表中,所有非金属元素都位于p区
D.在一个基态多电子的原子中,M层上的电子能量不一定比L层上的电子能量高
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.2.24 L(标准状况)苯在O2中完全燃烧,得到0.6NA个CO2分子
B.常温常压下,5.6g乙烯和环丙烷的混合气体中含有的碳原子数为0.4NA
C.1L 0.1 mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
D.1mol甲苯中有含有6NA个C-H键
难度: 中等查看答案及解析
-
如图所示为用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是TiO2中的氧解离进入熔融盐中而得到纯钛。下列说法中正确的是
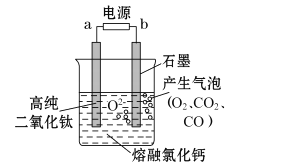
A.a极是正极,石墨极是阴极
B.阴极的电极反应式为:TiO2 + 4e-= Ti+2O2-
C.电解过程中,O2-、Cl-均向阴极移动
D.反应后,石墨电极的质量不发生变化
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
实验结论
A
在试管里加入10%的CuSO4溶液2mL,滴入2%的NaOH溶液4~6滴,得到新制的氢氧化铜,振荡后加入乙醛溶液0.5mL,加热,产生红色沉淀。
醛基能被新制Cu(OH)2氧化
B
取少量卤代烃加NaOH水溶液共热,冷却,再加AgNO3溶液,产生白色沉淀。
该卤代烃为氯代烃
C
实验室验证乙烯的生成,用如图装置和试剂。一段时间后,观察到酸性高锰酸钾溶液褪色。

说明乙醇和浓硫酸共热可生成乙烯
D
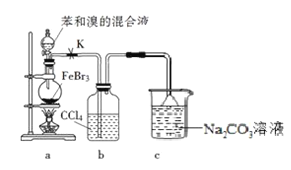
实验室制备溴苯的反应装置如图所示。实验中观察到b中液体变为浅红色,c中有气泡产生。
该装置可验证苯在催化剂作用下能与液溴发生取代反应
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列实验的反应原理及对应的离子方程式错误的是
A.泡沫灭火器的原理:Al3+ + 3HCO3- = Al(OH)3↓+ 3CO2↑
B.可用NH4Cl溶液除铁锈的原因是:NH4++H2O
NH3·H2O+H+
C.向苯酚钠溶液中通少量CO2会出现白色浑浊:C6H5O- + CO2 + H2O→C6H5OH + CO32-
D.用肥皂(主要成分C17H35COONa)检验含有较多钙离子的硬水:2C17H35COO- + Ca2+ = (C17H35COO)2Ca↓
难度: 中等查看答案及解析
-
如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是
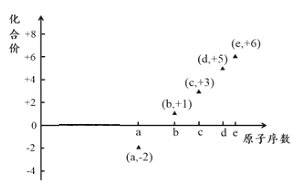
A.33e和34e化学性质明显不同
B.第一电离能d>e;电负性:d>a
C.气态氢化物的稳定性:a>e>d
D.a与b形成的化合物不可能含有共价键
难度: 简单查看答案及解析
-
X、Y、Z、W 为原子序数依次增大的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W形成的最高价氧化物分别为甲、乙、丙,丙常用于制作光导纤维。x、y2、z、w分别为X、Y、Z、W的单质,丁是化合物。其转化关系如图所示,下列判断错误的是

A.四种元素中,W的原子半径最大
B.反应①②③都属于氧化还原反应
C.Na着火时,不可用甲扑灭
D.一定条件下,x与甲反应生成丁
难度: 中等查看答案及解析
-
下列有机物同分异构体数目判断错误的是
选项
有机物
同分异构体数目
A
某烃相对氢气的密度为28,且不能使溴的四氯化碳溶液褪色
2
B
萘
的七氯代物
4
C
分子式为C5H12O,可被氧化为醛
4
D
分子式为C3H8O的醇与分子式为C4H8O2的羧酸形成的酯
4
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
常温下,下列有关溶液的说法正确的是
A.pH相等的①NH4Cl ②NH4Al(SO4)2 ③NH4HSO4溶液:浓度的大小顺序为①>②>③
B.HA的电离常数Ka =4.93×10−10,则等浓度的NaA、HA混合溶液中:c(Na+) >c(HA) >c(A−)
C.NaHCO3溶液加水稀释,c(Na+)与c(HCO3−)的比值将减小
D.已知在相同条件下酸性HF >CH3COOH,则物质的量浓度相等的NaF与CH3COOK溶液中:c(Na+) – c(F−) >c(K+ ) − c(CH3COO−)
难度: 中等查看答案及解析
-
化合物A经李比希法和质谱法分析得知其分子式是C8H8O2,相对分子质量为136。A分子中只含一个苯环,且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图。关于A的下列说法中,不正确的是
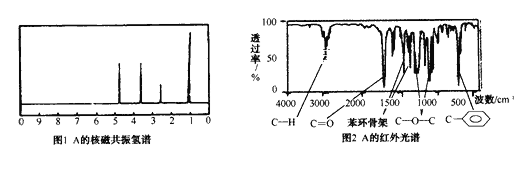
A.A分子属于酯类化合物,在一定条件下能发生水解反应
B.符合题中A分子结构特征的有机物只有一种
C.1mol A在一定条件下可与3mol H2发生加成反应
D.与A属于同类化合物的同分异构体只有3种
难度: 困难查看答案及解析
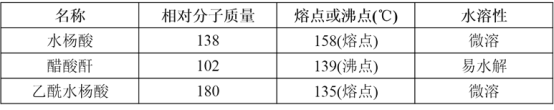
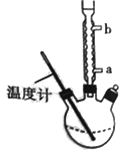
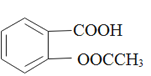 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下: