-
化学与生活、工农业生产密切相关,下列有关说法错误的是( )
A.用明矾净水是因为Al3+水解生成的Al(OH)3胶粒具有很强的吸附性
B.点燃爆竹后,硫燃烧生成SO3,污染环境
C.加热能杀死流感病毒是因为蛋白质受热变性
D.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
难度: 简单查看答案及解析
-
下列物质分类正确的是( )
A.化合物:氯化钡、纯碱、干冰
B.混合物:碱石灰、水玻璃、液氯
C.氧化物:过氧化钠、臭氧、一氧化碳
D.电解质:盐酸、烧碱、氯化钠溶液
难度: 中等查看答案及解析
-
下列各组离子在pH=1的水溶液中能够大量
共存的是( )
A.Ca2+;K+;CO
;Cl-
B.Na+;SO
;Cl-;K+
C.Na+;Fe2+;NO
;SO
D.Na+;K+;CH3COO-;SO
难度: 中等查看答案及解析
-
已知异丙苯的结构简式如图,下列说法错误的是( )
A. 异丙苯的分子式为C9H12
B. 异丙苯的沸点比苯高
C. 异丙苯和苯互为同系物
D. 异丙苯中碳原子可能都处于同一平面
难度: 中等查看答案及解析
-
新制氯水中存在下列平衡:Cl2+H2O
H
Cl+HClO,向新制
氯水中加入少量下列物质,能增强溶液漂白能力的是( )
A.稀盐酸 B.氯化钠溶液
C.碳酸钙粉末 D.二氧化硫水溶液
难度: 中等查看答案及解析
-
反应A+B→C(放热)分两步进行:①A+B→X(吸热),②X→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是( )
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.室温下,21.0 g乙烯气体中含有的碳原子数目为1.5NA
B.1 L 0.l mol/L的Na2
CO3溶液中含有的CO
数目为0.1
NA
C.标准状况下,11.2 L CH3CH2OH中含有分子的数目为0.5NA
D.在密闭容器中加入1. 5 mol H2和0.5 mol N2,充分反应后NH3的分子数为NA
难度: 困难查看答案及解析
-
常温下,甲溶液的pH=4,乙溶液的pH=5,甲溶液与乙溶液中由水电离的c(H+)之比不可能的是( )
A.1︰10 B.10︰1 C.1︰105 D.2︰1
难度: 中等查看答案及解析
-
下列离子反应方程式正确的是( )
A.往FeCl3溶液中加入Fe粉:Fe3+ +Fe=2Fe2+
B.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH
D.碳酸氢钠溶液中加入过量石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+CO
+2H2O
难度: 中等查看答案及解析
-
已知下列反应:Co2O3+6HCl(浓)=2CoCl2+Cl2↑+3H2O (Ⅰ)
5Cl2+I2+6H2O= 10HCl+2HIO3 (Ⅱ)
下列说法正确的是( )
A.还原性:CoCl2>HCl>I2 B.氧化性:Co2
O3>Cl2>HIO3
C.反应Ⅰ中HCl是氧化剂 D.反应Ⅱ中Cl2发生氧化反应
难度: 中等查看答案及解析
-
同周期的X、Y、Z三种元素,已知其高价氧化物对应的水化物的酸性强弱顺序是:HXO4 >H2YO4>H3ZO4,则下列各判断中正确的是( )
A. 非金属性:X>Y>Z B. 原子半径:X>Y>Z
C. 气态氢化物稳定性:X<Y<Z D. 原子序数:X<Y<Z
难度: 中等查看答案及解析
-
下列根据实验操作和现
象所得出的结论正确的是( )
实验操作
实验现象
结论
A
淀粉与稀H2SO4共热,再加银氨溶液水浴加热
无银镜生成
淀粉水解产物无还原性
B
向某溶液中先滴加氯水,再滴加少量KSCN溶液
溶液变成血红色
溶液中含有Fe2+
C
将铜粉加入到1.0 mol/L Fe2(SO4)3溶液中
溶液变蓝,有黑色固体出现
证明金属铁比铜
活泼
D
将CO2通入Na2SiO3溶液中
有白色沉淀生成
证明H2CO3酸性比H2SiO3强
难度: 困难查看答案及解析
-
常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L盐酸和20.00 mL 0.1000 mol/L醋酸溶液,得到2条滴定曲线,如下图所示。若用HA表示酸,下列说法正确的是( )
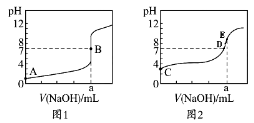
A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A-)
C.达
到B、E状态时,
反应消耗的n(CH3COOH)>n(HCl)
D.当V(NaOH)=20.00 mL时,两混合溶液中各离子浓度由大到小的顺序均为c(Na+)>c(A-)>c(OH-)>c(H+)
难度: 困难查看答案及解析
-
下列说法不正确的是( )
A
B
C
D
通电一段时间后,搅拌均匀,溶液的pH增大
甲电极上的电极反应为:
2Cl--2e- = Cl2↑
Pt电极上的电极反应为:O2+2H2O+4e-==4OH-
总反应的离子方程式为:
2Fe3++Cu=Cu2++ 2Fe2+
难度: 中等查看答案及解析
-
不同温度(T1和T2)时,硫酸钡在水中的沉淀溶解平衡曲线如图所示(已知硫酸钡在水中溶解时吸收热量)。下列说法正确的是( )
A.T1>T2
B.加入BaCl2
固体,可使a点变成c点
C.c点时,在T1、T2两个温度下均有固体析出
D.a点和b点的Ksp相等
难度: 困难查看答案及解析