-
我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na
2Na2CO3+C。下列说法错误的是( )

A.放电时,ClO4-向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为:3CO2+4e-=2CO32-+C
D.充电时,正极反应为:Na++e-=Na
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:
、
、
、
B.
=1×10-12的溶液中:K+、
、
、
C.
的溶液中:
、
、
、
D.能使甲基橙变红的溶液中:
、
、
、
难度: 简单查看答案及解析
-
倒置的坩埚盖子上放入硫粉,在硫粉中央放一小块钠,按图示搭建装置,用胶头滴管向金属钠滴加一滴水,立即倒扣上大烧杯,发现坩埚盖子内火星四溅,烧杯内出现大量白烟,下列说法错误的是( )

A.水是钠与硫反应的催化剂 B.酚酞的水溶液变红色
C.钠与硫的反应是放热反应 D.滤纸逐渐变黑
难度: 中等查看答案及解析
-
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:
。下列有关物质的推断不正确的是
A.若甲为Cl2,则丁可能是铁 B.若甲为NH3,则丁可能是氧气
C.若甲为AlCl3溶液,则丁可能是氨水 D.若甲为NaOH,则丁可能是SO2
难度: 中等查看答案及解析
-
室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
难度: 中等查看答案及解析
-
下图是合成香料香豆素过程的中间产物,关于该物质的说法不正确的是( )
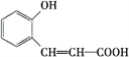
A. 分子式为C9H8O3
B. 有两种含氧官能团
C. 1 mol该物质最多能与5 mol H2发生加成反应
D. 该物质在一定条件下可发生酯化反应
难度: 中等查看答案及解析
-
根据图判断,下列说法不正确的是( )
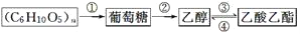
A.(C6H10O5)n可表示淀粉或纤维素
B.反应②化学方程式为C6H12O6
2C2H5OH+2CO2↑
C.相同质量的上述四种物质完全燃烧,葡萄糖产生的CO2最多
D.反应①、③和④都属于取代反应
难度: 中等查看答案及解析