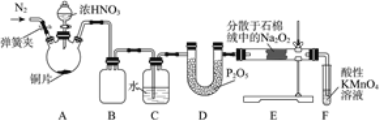-
五千年中华历史创造了绚丽多彩的中华文明,下列说法错误的是
A.豆腐的制作过程利用了胶体的性质
B.制作月饼所用的面粉、鸡蛋清和植物油均属于天然高分子化合物
C.秦朝兵马俑的制作原料主要是硅酸盐,属于无机非金属材料
D.“越王勾践剑”的制作原料为青铜,属于合金
难度: 简单查看答案及解析
-
由苯乙烯制备乙苯的反应原理为:
+H2―→
,下列说法正确的是
A.苯乙烯和乙苯均能使溴的CCl4溶液褪色
B.乙苯中所有原子可能处于同一平面
C.等质量的苯乙烯和乙苯完全燃烧,苯乙烯消耗O2更多
D.乙苯的一氯代物有5种(不考虑立体异构)
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.常温下,pH=2的稀硫酸溶液中所含H+数目为0.01NA
B.标准状况下,5.6 L Cl2与5.6 g铁粉反应,转移电子数目为0.5NA
C.常温常压下,1.4 g丙烯和正丁烯的混合气体中碳原子数目为0.1NA
D.高温高压下,1 mol N2与4 mol H2充分反应,所得NH3分子数目为2NA
难度: 中等查看答案及解析
-
新型双膜锌碘单流电池的工作原理如图所示,放电过程中两膜之间的KCl溶液浓度不断降低。下列说法正确的是

A.锌电极电势高于多孔碳电极电势
B.cd膜可以选用阴离子交换膜
C.多孔碳电极上发生的电极方程式为I3-+2e-=3I-
D.若导线上通过1 mol电子,会有1 mol K+通过ab膜
难度: 中等查看答案及解析
-
常温下氯化铁为棕黑色固体,易升华。实验室欲证明H2能在加热的条件下还原FeCl3,设计如下实验。下列说法错误的是

A.装置A的优点是随开随用,随关随停
B.导管m的作用是平衡压强,观察是否堵塞
C.装置D中产生白色沉淀即可证明H2能还原FeCl3
D.实验结束后,应先熄灭C处酒精灯,待硬质玻璃管冷却后关闭K
难度: 中等查看答案及解析
-
A、B、C、D为原子序数依次增大的短周期主族元素,a、d分别是A、D元素对应的单质,m、n、p、q是由这些元素中的部分元素组成的化合物,气体p常作果实催熟剂,m、n为两种常见的液体。上述物质发生的转化关系如下图所示(反应条件已略去)。下列说法错误的是
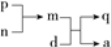
A.原子半径由大到小的顺序为:D>B>C>A
B.简单氢化物的沸点:B<C
C.d与m反应的现象为浮在液面上四处游动
D.C与D形成的化合物中一定含有离子键
难度: 简单查看答案及解析
-
常温下,用0.1mol/L盐酸或NaOH溶液滴定体积均为20 mL,浓度均为0.1mol/L的MOH、HX溶液,滴定曲线如图所示。下列说法错误的是

A.两个滴定实验均可用酚酞作指示剂
B.常温下0.1mol/LMX溶液的pH<7
C.a点溶液中存在:c(X-)>c(HX)
D.b点溶液中存在:2c(MOH)+c(M+)+c(OH-)=c(H+)
难度: 中等查看答案及解析