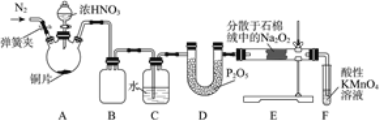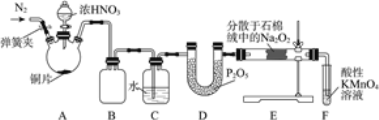-
亚硝酸钠(NaNO2)是工业盐的主要成分,在漂白、电镀等方面应用广泛。实验室利用下图装置制备亚硝酸钠,并测定所制亚硝酸钠的纯度。(加热装置及部分夹持装置已略去)
Ⅰ.亚硝酸钠的制备。
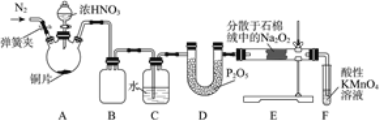
(1)盛放浓HNO3的仪器的名称为__________;装置B的作用是______________。
(2)装置E中制取NaNO2的化学方程式为___________________。
(3)多余的NO在装置F中被氧化为NO3-,反应的离子方程式为_____________。
(4)实验结束后打开A中弹簧夹,通入N2的目的是_______________。
Ⅱ.亚硝酸钠纯度的测定。
当Na2O2完全反应后,E中产生的固体除NaNO2外,还可能有NaNO3。测定亚硝酸钠纯度的步骤如下:
步骤一:取反应后的固体4.30 g溶于稀硫酸,向所得溶液中加入足量KI,将溶液中的NO2-和NO3-全部还原为NO,并通入足量N2,将NO全部赶出,最后将溶液稀释至1000 mL。
步骤二:取上述所得溶液10 mL,用淀粉作指示剂,用0.050 mol/L的Na2S2O3标准液滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,最终消耗Na2S2O3溶液体积为16.00 mL。
(5)步骤二中达到滴定终点的标志为______________________。
(6)混合固体中NaNO2的质量分数为________。(保留三位有效数字)
(7)若在滴定终点读取滴定管刻度时,仰视标准液液面,则测得亚硝酸钠的纯度________。(填“偏高”“偏低”或“无影响”)
-
亚硝酸钠(NaNO2)是工业盐的主要成分,在漂白、电镀等方面应用广泛。实验室利用下图装置制备亚硝酸钠,并测定所制亚硝酸钠的纯度。(加热装置及部分夹持装置已略去)
Ⅰ.亚硝酸钠的制备。
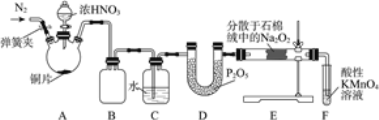
(1)盛放浓HNO3的仪器的名称为__________;装置B的作用是______________。
(2)装置E中制取NaNO2的化学方程式为___________________。
(3)多余的NO在装置F中被氧化为NO3-,反应的离子方程式为_____________。
(4)实验结束后打开A中弹簧夹,通入N2的目的是_______________。
Ⅱ.亚硝酸钠纯度的测定。
当Na2O2完全反应后,E中产生的固体除NaNO2外,还可能有NaNO3。测定亚硝酸钠纯度的步骤如下:
步骤一:取反应后的固体4.30 g溶于稀硫酸,向所得溶液中加入足量KI,将溶液中的NO2-和NO3-全部还原为NO,并通入足量N2,将NO全部赶出,最后将溶液稀释至1000 mL。
步骤二:取上述所得溶液10 mL,用淀粉作指示剂,用0.050 mol/L的Na2S2O3标准液滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,最终消耗Na2S2O3溶液体积为16.00 mL。
(5)步骤二中达到滴定终点的标志为______________________。
(6)混合固体中NaNO2的质量分数为________。(保留三位有效数字)
(7)若在滴定终点读取滴定管刻度时,仰视标准液液面,则测得亚硝酸钠的纯度________。(填“偏高”“偏低”或“无影响”)
-
(亚硝酸钠(NaNO2)是工业盐的主要成分,在漂白、电镀等方面应用广泛。实验室利用下图装置制备亚硝酸钠,并测定所制亚硝酸钠的纯度。(加热装置及部分夹持装置已略去)
Ⅱ.亚硝酸钠纯度的测定。
当Na2O2完全反应后,E中产生的固体除NaNO2外,还可能有NaNO3。测定亚硝酸钠纯度的步骤如下:
步骤一:取反应后的固体4.30 g溶于稀硫酸,向所得溶液中加入足量KI,将溶液中的NO2-和NO3-全部还原为NO,并通入足量N2,将NO全部赶出,最后将溶液稀释至1000 mL。
步骤二:取上述所得溶液10 mL,用淀粉作指示剂,用0.050 mol/L的Na2S2O3标准液滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,最终消耗Na2S2O3溶液体积为16.00 mL。
(1)步骤二中达到滴定终点的标志为______________________。
(2)混合固体中NaNO2的质量分数为________。(保留三位有效数字)
(3)若在滴定终点读取滴定管刻度时,仰视标准液液面,则测得亚硝酸钠的纯度________。(填“偏高”“偏低”或“无影响”)
-
亚硝酸钠(NaNO2)是工业盐的主要成分,在漂白、电镀等方面应用广泛。实验室以木炭、浓硝酸、Na2O2为主要原料按照如图所示装置制各亚硝酸钠(加热装置及部分夹持装置已略去),反应原理为:2NO+Na2O2=2NaNO2。
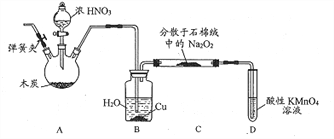
回答下列问题:
(1)A装置中反应的化学方程式为__________________。
(2)B装置中铜的作用是__________________。
(3)充分反应后,C中生成的固体除NaN02外,还可能有杂质生成,应在B、C之间加一个装置,该装置所盛放试剂的名称是_________________。
(4)检查装置气密性并装入药品后,以下实验操作步骤正确的顺序为____________________填标号)。
a.打开弹簧夹,向装置中通入N2 b.点燃酒精灯
c.向三颈烧瓶中滴加浓硝酸 d.熄灭酒精灯
e.关闭分液漏斗旋塞 f.停止通入N2
(5)D装置用于尾气处理,写出D中反应的离子方程式:___________________。
(6)利用改进后的装置,将7.8gNa2O2完全转化成NaNO2,理论上至少需要木炭____g。
-
亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。某小组制备亚硝酸钠的实验装置如图所示(部分夹持装置已略去)。
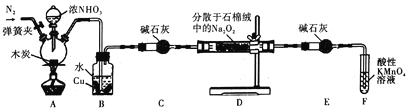
已知:
①2NO+Na2O2=2NaNO2、2NaNO2+O2=2NaNO3
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O
③酸性条件下,NO或NO2都能与MnO4-反应生成NO3-和Mn2+
回答下列问题:
(1)反应前需先打开弹簧夹,通入氮气排尽装置中的空气,原因是__________________。
(2)装置A中反应的化学方程式为_________________;装置B中的实验现象为_____________,铜片逐渐溶解并有气泡产生。
(3)若省略装置C,则装置D中的固体产物除NaNO2、NaOH外,还有__________、___________(填化学式)。检验产物中含有NaNO2的方法是:取少量样品于试管中,_____________________,则说明产物中含有NaNO2。
(4)装置E的作用是___________________________。
(5)NaNO2有像食盐一样的咸味,但能引起中毒。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O。根据上述反应,可以用试剂和生活中常见的物质进行实验,以鉴别亚硝酸钠和食盐。进行实验时,除样品外必须选用的物质有_________ (填标号)。
a.白酒 b.碘化钾、淀粉溶液 c.白醋 d.白糖
(6)充分反应后,该小组设计实验检测产物中NaNO2的含量。称取装置D中固体2.3000g,完全溶解配制成溶液l00mL,取出25.00mL溶液用0.100 mol·L-1酸性KMnO4溶液进行滴定(杂质不与KMnO4反应),三次滴定平均消耗KMnO4溶液30.00mL,则样品中NaNO2的质量分数为_______________。(已知:NaNO2的摩尔质量为69g·mol-1)
-
亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。实验室用如图所示装置制备亚硝酸钠。请回答下列问题:
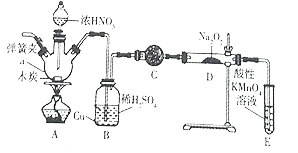
已知:①3NaNO2 +3HCl=3NaCl+HNO3 +2NO↑+H2O
②酸性条件下,NO或NO2- 都能与MnO4-反应生成NO3- 和Mn2+
(1)仪器a的名称是_____________。
(2)B 装置中的主要现象是_______。C 中的试剂可以是____________。
(3)D 中反应生成NaNO2的化学方程式为_______。E 装置的作用是______________。
(4)检验D装置中生成NaNO2
| 操作 | 现象 | 结论 |
| _____________ | ____________ | 有 NaNO2生 成 |
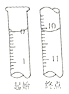
(5) NaNO2有毒,国家规定肉制品中NaNO2含量不能超过30 mg/kg。从1000 g隔夜熟肉中提取NaNO2后,配成溶液,再用0.0050mol/L的酸性高锰酸钾溶液滴定,滴定起始和终点的液面位置如图所示,计算隔夜熟肉中NaNO2的含量是_______mg/kg。
-
亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料制备亚硝酸钠的装置如图所示(A中加热装置省略)。
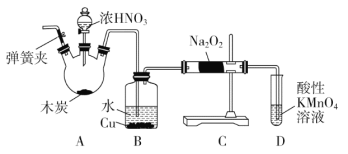
已知:室温下,①2NO+Na2O2=2NaNO2;
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+。
请按要求回答下列问题:
(1)A装置中反应的化学方程式为______________________________。
(2)B装置中主要的现象是______________________________。
(3)检验C装置产物中有亚硝酸钠的方法是_____________________________。
(4)D装置中反应的离子方程式为_________________________________。
(5)预测C中反应开始阶段,固体产物除NaNO2外,还含有的副产物有Na2CO3和________。为避免产生这些副产物,应在B、C装置间增加装置E,则E中盛放的试剂名称为________。
(6)检查装置气密性并装入药品后,以下实验操作步骤正确的顺序为____________(填序号)。
a.打开弹簧夹,向装置中通入N2
b.点燃酒精灯
c.向三颈烧瓶中滴加浓硝酸
d.熄灭酒精灯
e.关闭分液漏斗欧旋塞
f.停止通入N2
(7)利用改进后的装置,将7.8gNa2O2完全转化为亚硝酸钠,理论上需要木炭______g。
-
亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料制备亚硝酸钠的装置如图所示(A中加热装置省略)。
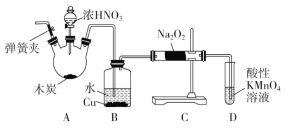
已知:室温下,①2NO+Na2O2=2NaNO2;
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+。
请按要求回答下列问题:
(1)A装置中反应的化学方程式为_________。
(2)B装置中主要的现象是________。
(3)检验C装置产物中有亚硝酸钠的方法是_______。
(4)D装置中反应的离子方程式为________。
(5)预测C中反应开始阶段,固体产物除NaNO2外,还含有的副产物有Na2CO3和________。为避免产生这些副产物,应在B、C装置间增加装置E,则E中盛放的试剂名称为________。
(6)检查装置气密性并装入药品后,以下实验操作步骤正确的顺序为____________(填序号)。
a.打开弹簧夹,向装置中通入N2 b.点燃酒精灯 c.向三颈烧瓶中滴加浓硝酸 d.熄灭酒精灯e.关闭分液漏斗欧旋塞 f.停止通入N2
-
亚硝酸钠 是工业盐的主要成分,在漂白、电镀等方面应用广泛。已知:室温下,
是工业盐的主要成分,在漂白、电镀等方面应用广泛。已知:室温下, ,以木炭、浓硝酸、
,以木炭、浓硝酸、 为主要原料制备亚硝酸钠的装置如图所示
为主要原料制备亚硝酸钠的装置如图所示 部分夹持装置已略去
部分夹持装置已略去 。下列说法正确的是( )
。下列说法正确的是( )
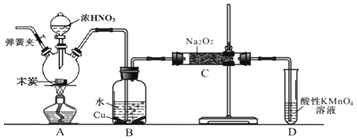
A.可以将B中药品换成NaOH溶液
B.应在B、C之间加一个盛放无水 的干燥管
的干燥管
C.实验开始前先向装置中通入 ,实验结束时先停止通入
,实验结束时先停止通入 再熄灭酒精灯
再熄灭酒精灯
D.装置D可用于尾气处理,标况下每吸收 L的尾气消耗
L的尾气消耗 mol高锰酸钾
mol高锰酸钾
-
亚硝酸钠 是工业盐的主要成分,在漂白、电镀等方面应用广泛。已知:室温下,
是工业盐的主要成分,在漂白、电镀等方面应用广泛。已知:室温下, ,以木炭、浓硝酸、
,以木炭、浓硝酸、 为主要原料制备亚硝酸钠的装置如图所示
为主要原料制备亚硝酸钠的装置如图所示 部分夹持装置已略去
部分夹持装置已略去 。下列说法正确的是( )
。下列说法正确的是( )
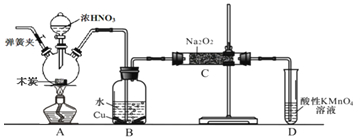
A.可以将B中药品换成NaOH溶液
B.应在B、C之间加一个盛放无水 的干燥管
的干燥管
C.实验开始前先向装置中通入 ,实验结束时先停止通入
,实验结束时先停止通入 再熄灭酒精灯
再熄灭酒精灯
D.装置D可用于尾气处理,标况下每吸收 L的尾气消耗
L的尾气消耗 mol高锰酸钾
mol高锰酸钾