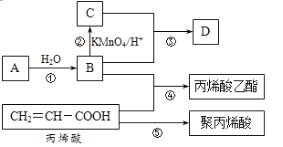
-
下列实验操作能达到目的的是
①用Na2S溶液和Al2(SO4)3溶液反应制取Al2S3固体 ②用加热蒸发K2CO3溶液的方法获得K2CO3晶体③用Na2S溶液和CuSO4溶液反应制取CuS固体 ④加热MgCl2溶液制取MgCl2固体
A.①② B.②③ C.③④ D.①③
难度: 中等查看答案及解析
-
下列有关资源的开发利用的说法正确的是 ( )
A.海水提取溴的过程中不发生氧化还原反应
B.全球“低碳”行动能减少CO2的排放量,从而降低酸雨的形成及危害
C.从海带中提取碘单质的过程一定涉及氧化还原反应
D.石油的分馏、煤的气化、海水晒盐、从花生中提取花生油等过程都是物理变化
难度: 简单查看答案及解析
-
下列化学用语正确的是( )
A. 羟基的电子式:
B. 乙酸的分子式:
C. 四氯化碳分子比例模型:
 D. 丙烷分子的比例模型:
D. 丙烷分子的比例模型:
难度: 中等查看答案及解析
-
下列关于物质水解的说法正确的是 ( )
A.纤维素属于营养物质,可被人体水解
B.油脂、糖类和蛋白质都能发生水解反应
C.淀粉水解液加碘水,可检测是否发生水解
D.淀粉和纤维素水解的最终产物均为葡萄糖
难度: 简单查看答案及解析
-
某有机物的结构简式如下,此有机化合物属于 ( )
①烯烃 ②多官能团有机化合物 ③芳香化合物 ④烃的衍生物
A.①②③④ B.② ④ C.② ③ ④ D.① ③
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数,下列叙述中正确的是 ( )
A.标准状况下,8.4g己烷中共价键数目为1.8NA
B.常温下,0.1mol乙烷与乙烯混合气体中所含碳原子数为0.2NA
C.在标准状况下,2.24 L氯仿中所含分子数为0.1NA
D.1mol苯分子中含有碳碳双键数为3NA
难度: 简单查看答案及解析
-
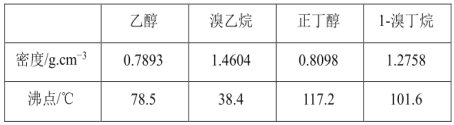
除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的的是 ( )
混合物
试剂
分离方法
A
乙醇(水)
生石灰
分液
B
乙烷(乙烯)
氢气
加热
C
乙酸乙酯(乙酸)
饱和Na2CO3溶液
蒸馏
D
淀粉(氯化钠)
蒸馏水
渗析
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
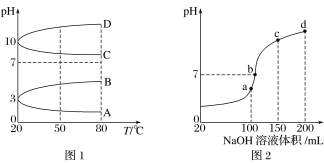
常温下,下列溶液中由水电离的氢离子浓度为1×10-5的是 ( )
A.pH=5的HClO 溶液 B.pH=9的氨水
C.pH=5的AlCl3溶液 D.pH=5的NaHSO4溶液
难度: 中等查看答案及解析
-
有关烷烃的命名正确的是
A.
 2-甲基丁烷
2-甲基丁烷B.
 2,4,4-三甲基戊烷
2,4,4-三甲基戊烷C.
 1,3-二甲基丁烷
1,3-二甲基丁烷D.如图所示烷烃的名称为:异戊烷

难度: 简单查看答案及解析
-
已知:H2A=H++HA-,HA- ⇌ H++A2-,则下列说法正确的是 ( )
A.H2A是弱酸
B.向H2A溶液中通入HCl气体,电离平衡逆向移动,则H2A浓度增大
C.向H2A溶液中加入金属Na,电离平衡常数增大
D.0.1mol/L H2A中pH<1
难度: 中等查看答案及解析
-
25℃,下列有关溶液中各微粒的物质的量浓度关系正确的是 ( )
A.0.lmol/L 的 NH4Cl 溶液:c(Cl-)>c(NH4+)>c (OH-)>c(H+)
B.0.lmol/L 的 CH3COOH 溶液:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-)
C.某 FeCl3溶液 pH=4: c(H+)>c(Cl-)>c(Fe3+)>c(OH-)
D.某弱酸的酸式盐 NaHA 溶液中一定有:c(OH-)+ 2c(A2-)= c(H+)+c(Na+)
难度: 中等查看答案及解析
-
下列说法正确的是
A.
与
都是α-氨基酸且互为同系物
B. CH3CH=CHCH3分子中的四个碳原子在同一直线上
C. 按系统命名法,化合物按系统命名法,化合物
的名称是2,3,4-三甲基-2-乙基戊烷
D.
的一溴代物和
的一溴代物都有4种(不考虑立体异构)
难度: 中等查看答案及解析
-
下列叙述正确的个数 ( )
①己烷有4种同分异构体,它们的熔点、沸点各不相同
②用酸性高锰酸钾溶液可区分甲烷和乙烯
③乙烷室温下能与浓盐酸发生取代反应
④乙烯和聚氯乙烯都能使溴的四氯化碳溶液褪色
⑤甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红,说明生成的甲烷的氯代物具有酸性
⑥甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
⑦甲烷与足量氯气在光照下反应可生成难溶于水的油状液体
A.1 B.2 C.3 D.4
难度: 简单查看答案及解析
-
分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述正确的是( )

A.分子中含有2种含氧官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1 mol分枝酸最多可与3 mol NaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
难度: 中等查看答案及解析
-
两种烃组成的2L混合气体与足量的氧气充分反应后生成5L CO2、7L H2O(所有体积都在120℃下测定),则这两种混合气体的可能组成是 ( )
A.C2H4、C3H8 B.CH4、C3H6
C.CH4、C4H8 D.C2H6、C3H8
难度: 中等查看答案及解析
-
25 ℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液。观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25 ℃)如下:
AgCl
AgI
Ag2S
Ksp(单位省略)
1.8×10-10
1.5×10-16
6.3×10-50
下列叙述错误的是 ( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25 ℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
难度: 中等查看答案及解析
-
已知25℃时有关弱酸(或弱碱)的电离平衡常数:
弱酸(或弱碱)化学式
CH3COOH
NH3·H2O
H2CO3
电离平衡常数(25℃)
1.8×l0–5
1.8×l0–5
K1=4.3×l0–7 K2=5.6×l0–11
在25℃时,下列有关电解质溶液的说法不正确的是( )
A.pH相等的四种溶液:a.CH3COONa b.Na2CO3 c.NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d < b < c < a
B.0.1mol·L-1的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-)> c(H2CO3)
C.1 L 0.50 mol·L-1NH4Cl 溶液与2 L 0.25 mol·L-1NH4Cl 溶液,前者含NH4+ 物质的量多
D.浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-) > c(CH3COOH)+c(H+)
难度: 困难查看答案及解析
-
25℃时,有c(HA)+c(A-)=0.1mol/L 的一组HA、KA 混合溶液,溶液中c(HA)、c(A-)与pH 的关系如下图所示。下列叙述不正确的是 ( )

A.pH= 5.75 的溶液中: c(K+)>c(A- )>c(HA)> c (H+)>c(OH- )
B.欲得W 点所示溶液,起始所加溶液应符合c(HA)+c(A-)=0.1mol/L 且c(KA)<c(HA)
C.pH=3.75的溶液中:c(K+)+c(H+)-c(OH-)+c(HA)=0.1mol/L
D.若A-的水解常数为Kh ,则lgKh=-9.25
难度: 中等查看答案及解析