-
下列除去物质中少量杂质的方法正确的是
A. 除去CO2中混有的HCl:用饱和碳酸钠溶液,洗气
B. 除去KCl溶液中混有的K2SO4:加入过量BaCl2溶液,过滤
C. 除去FeCl3溶液中混有的FeCl2:加入过量铁粉,过滤
D. 除去NaCl固体中混有的NH4Cl:加热
难度: 中等查看答案及解析
-
将下列各组物质按酸、碱、盐分类顺序排列,正确的是( )
A.硫酸、纯碱、石膏 B.氢硫酸、烧碱、绿矾
C.碳酸、乙醇、醋酸钠 D.磷酸、熟石灰、苛性钾
难度: 简单查看答案及解析
-
已知I-、Fe2+、SO2、Cl- 和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-<Fe2+<H2O2<I-<SO2,则下列反应中不能发生的是( )
A.H2O2+H2SO4══SO2↑+O2↑+2H2O
B.I2+SO2+2H2O══H2SO4+2HI
C.2Fe2++Cl2══2Fe3++2Cl-
D.2Fe3++SO2+2H2O══2Fe2++SO42-+4H+
难度: 困难查看答案及解析
-
下列实验操作正确的是
选项
实验
操作
A
观察钠与水反应的现象
用镊子从煤油中取出金属钠,切下黄豆大小的钠,小心放入装满水的烧杯中
B
检验NaHCO3与Na2CO3溶液
用小试管分别取少量溶液,然后滴加澄清石灰水
C
证明Na2O2与CO2是放热反应
Na2O2用棉花包裹,放入充满CO2的集气瓶中,棉花燃烧说明是放热反应
D
检验Na2CO3与K2CO3溶液
用铂丝分别蘸取溶液,在酒精灯外焰上灼烧,直接观察火焰的颜色
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列危险化学品标志中表示腐蚀品的是
A.
 B.
B.  C.
C.  D.
D. 
难度: 简单查看答案及解析
-
下列有关物质的量和摩尔的叙述不正确的是( )
A.摩尔是国际单位制中七个基本单位之一
B.物质的量可用n 表示,1mol粒子的数目约为6.02×1023
C.摩尔的计量对象可以是分子、离子、原子、质子、中子、电子和原子团
D.用摩尔表示物质的量时,要用化学式指明较子种类,而不用该粒子的中文名称
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.同质量的H2和Cl2含有的分子数相等
B.SO42-的摩尔质量是96g/mol
C.阿伏加德罗常数恰好为6.02×1023mol-1
D.1molCO2的质量为44 g/mol
难度: 中等查看答案及解析
-
下列关于气体摩尔体积的说法正确的是( )
A.22.4L任何气体的物质的量均为1mol
B.非标准状况下,1mol任何气体不可能占有22.4 L体积
C.标况下,CO2气体摩尔体积是22.4L/mol
D.某物质含有6.02×1023个粒子,则该物质的体积为22.4L
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数,下列说法正确的是( )
A.0.1mol Fe 与0.1mol Cl2反应,转移的电子数目为0.3NA
B.1.12L Cl2 含有1.7NA个质子
C.标准状况下,22.4L SO3含NA个硫原子数
D.3.2g O2和O3的混合物中含有的氧原子数目为0.2NA
难度: 中等查看答案及解析
-
下列关于物质的量浓度表述正确的是( )
A.0.3mol/L的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9mol
B.当1L水吸收22.4L氨气时所得氨水的浓度不是1mol/L,当22.4L氨气溶于水制得1L氨水时,其浓度是1mol/L
C.在K2SO4和NaCl的混合溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同
D.250g胆矾溶于水得到1L溶液,所得CuSO4溶液的物质的量浓度为1mol/L
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.对于质量相同的CH4和O2,二者体积比为2:1
B.等压等体积的N2O和CO2所含的原子数一定相等
C.同温同压下,等质量的CO和CO2气体所含碳原子数比为1:1
D.等体积等密度的O2和O3,所含的原子数一定相等
难度: 中等查看答案及解析
-
下列关于胶体的叙述中,不正确的是( )
A.用半透膜除去淀粉胶体中的NaCl溶液,用过滤能分离淀粉胶体中的泥沙
B.某纳米材料微粒直径为30nm,因此该纳米材料属于胶体
C.丁达尔效应可以区分溶液和胶体
D.“血液透析”利用了胶体的性质
难度: 中等查看答案及解析
-
和下列离子反应方程式相对应的化学方程式正确的是( )
A.Cu2++2OH-=Cu(OH)2↓ CuSO4+Ba(OH)2=Cu(OH)2↓+BaSO4↓
B.Ba2++SO42-=BaSO4↓ Ba(OH)2+H2SO4=BaSO4↓+2H2O
C.Ag++Cl-=AgCl↓ AgNO3+NaCl=AgCl↓+NaNO3
D.Cu+2Ag+=Cu2++2Ag Cu+2AgCl=2Ag+CuCl2
难度: 中等查看答案及解析
-
能发生离子反应,但不会产生沉淀的是
A.澄清石灰水中通入CO2 B.NaHCO3溶液中滴加NaOH溶液
C.Na2CO3溶液中滴加NaOH溶液 D.氯化钠溶液中滴加硝酸银溶液
难度: 简单查看答案及解析
-
下列各组离子中能大量共存的是
A.无色溶液中:K+、Na+、MnO4﹣、SO42﹣
B.在酸性溶液中:Mg2+、Na+、SO42﹣、Cl﹣
C.能使pH试纸变蓝色的溶液:Cl﹣、HCO3﹣、SO42﹣、NH4+
D.碱性溶液中:K+、Cl﹣、NO3﹣、Cu2+
难度: 中等查看答案及解析
-
有关金属及其化合物的用途正确的是( )
A.用铝制餐具做酸辣凉拌菜 B.钢铁是我国发明使用最早的合金
C.氧化钠用于潜水艇中做供氧剂 D.氧化铝是一种耐高温材料
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.含有最低价元素的化合物不一定具有很强的还原性
B.氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原
C.阳离子只能得电子被还原,阴离子只能失电子被氧化
D.在化学反应中,得电子越多的氧化剂,其氧化性就越强
难度: 中等查看答案及解析
-
下列配制的溶液浓度偏高的是( )
A.配制盐酸溶液用量筒取盐酸时俯视刻度线
B.NaOH溶解后溶液未冷却到室温,就转移到容量瓶中,立即定容
C.配制盐酸定容时,仰视容量瓶刻度线
D.称量25.0g胆矾配制0.1mol/L CuSO4溶液1000mL时,砝码错放在左盘
难度: 中等查看答案及解析
-
如图是实验室某硫酸试剂瓶标签上的部分内容,据此下列说法正确的是( )

A.该硫酸的物质的量浓度为9.2 mol/L
B.该硫酸与等体积的水混合所得溶液的质量分数等于49%
C.配制500 mL 4.6 mol/L的稀硫酸需取该硫酸125.0 mL
D.1molFe与足量的稀硫酸反应,标准状况下产生44.8L气体
难度: 中等查看答案及解析
-
某溶液中含有Cl-和I-的物质的量浓度相同。为了氧化I-而不使Cl-氧化,试根据下列三个反应判断,可选用的氧化剂是( )
①2Fe3++2I-=2Fe2++I2
②2Fe2++Cl2=2Fe3++2I-
③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O
A.FeCl2 B.FeCl3 C.浓盐酸 D.KMnO4
难度: 中等查看答案及解析
-
Cl2是常见的氧化剂,可氧化Fe2+、Br-、I-等离子,且已知还原性顺序是:I->Fe2+>Br->Cl-。在FeI2和FeBr2混合溶液中,通入一定量Cl2,溶液中存在的离子组不合理的是( )
A.Fe3+、Br-、Cl- B.Fe2+、Cl-、I-
C.Fe2+、Br-、Cl- D.Fe2+、Br-、Cl-、I-
难度: 中等查看答案及解析
-
以下10种化合物中,不能通过化合反应直接生成的有( )
①Fe3O4;②Fe(OH)3;③FeCl2;④CuS;⑤Cu2S;⑥Cu2(OH)2CO3;⑦Al(OH)3;⑧Na2CO3;⑨NaHCO3;⑩Na2O2
A.2种 B.3种 C.4种 D.5种
难度: 中等查看答案及解析
-
有100mLMgCl2和AlCl3的混合溶液,其中c(Mg2+)为0.1mol/L,c(Cl-)为0.65mol/L,要使Mg2+转化为沉淀分离出来,至少需加1mol/L NaOH溶液体积是( )
A.40mL B.60mL C.80mL D.120 mL
难度: 困难查看答案及解析
-
有铁、氧化铁、四氧化三铁的混合物3.64克,加入50mL2mol/L盐酸溶液时,恰好完全反应,并且生成气体的体积在标准状况下为0.224升,向所得溶液中滴加KSCN溶液无明显变化。若将等质量的该混合物在CO中加热并充分反应,冷却后固体的质量为( )
A. 2 .8克 B. 1.52克 C. 3.4克 D. 2克
难度: 困难查看答案及解析
-
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Ba2+、CO32-、SO42-,现取三份各100mL溶液进行如下实验:(1)第一份加入AgNO3溶液有沉淀产生。(2)第二份加足量NaOH溶液加热后,收集到0.04mol气体。(3)第三份加足量BaCl2溶液后,得到干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。综合上述实验,你认为以下结论正确的是( )
A.该混合液中一定含有:K+、NH4+、CO32-、SO42-、Cl-
B.该混合液中一定含有:NH4+、CO32-、SO42-,可能含K+、Cl-
C.该混合液中一定含有:NH4+、CO32-、SO42-、Cl-,可能含K+
D.该混合液中:c(K+)≥0.2mol/L,c(CO32-)=0.2mol/L
难度: 困难查看答案及解析
-
在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol•L-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述不正确的是( )
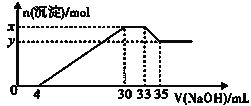
A.x-y=0.01mol B.原溶液中c(Cl-)=0.75mol/L
C.原溶液的c(H+)=0.1mol/L D.原溶液中n(Mg2+):n(Al3+)=5:1
难度: 中等查看答案及解析