-
下列选项中,利用相关实验器材(规格和数量不限)能够完成相应实验的是
选项
实验器材
相应实验
A
天平(带砝码)、100mL容量瓶、烧杯、胶头滴管
配制100mL1.00mol /L NaCl溶液
B
烧杯、环形玻璃搅拌棒、碎泡沫塑料、硬纸板
中和反应反应热的测定
C
酸/碱式滴定管、滴定管夹、烧杯、锥形瓶、铁架台
实验测定酸碱滴定曲线
D
三脚架、酒精灯、坩埚、坩埚钳、镊子、泥三角
钾在空气中燃烧
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.乙醚和乙醇互为同分异构体
B.苯与苯乙烯具有相同最简式但不是同系物
C.
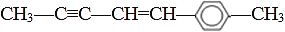 分子中最多可以有20个原子共平面
分子中最多可以有20个原子共平面D.CH3CH2CH2CH3和C(CH3)4互为同系物
难度: 中等查看答案及解析
-
常温下,有关盐酸与醋酸溶液的说法正确的是( )
A.pH=2.0 的盐酸和醋酸溶液,等体积混合后溶液的 pH >2.0
B.浓度为0.1 mol·L -1 等体积的盐酸和醋酸溶液加水稀释 10 倍后,c( Cl-)> c(CH3COO- )
C.相同浓度的两溶液,分别与NaOH 固体反应后呈中性的溶液中(忽略溶液体积变化):c(CH3COO-)=c(Cl- )
D.等浓度的盐酸和醋酸与足量的锌反应产生气体的体积(同温同压时)相同
难度: 中等查看答案及解析
-
某温度下重水(D2O)的离子积常数为1.6×10-15,用定义pH一样来规定pD=-lg{c(D+)},则该温度下,下列叙述正确的是
A.纯净的重水(D2O)中,pD=7
B.1 L溶解有0.01 mol DCl的重水溶液,其pD=12.0
C.纯净的重水中,c(D+)=c(OD-)
D.1 L溶解有0.01 mol NaOD的重水溶液,其pD=12.0
难度: 中等查看答案及解析
-
已知常温下浓度为0.lmol/L的下列溶液的pH如下表,下列有关说法正确的是( )
溶质
NaF
NaClO
Na2CO3
pH
7.5
9.7
11.6
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序: H2CO3< HClO<HF
B.向上述NaC1O溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>(H+)>c(HClO) >c(OH-)
C.根据上表,水解方程式ClO-+H2O
HClO+OH-的水解常数K=10-7.6
D.若将CO2通入0.lmol/LNa2CO3溶液中至溶液中性,则溶液中2c(CO32-)+c(HCO3-)=0.1 mol/L
难度: 中等查看答案及解析
-
世界某著名学术刊物近期介绍了一种新型中温全瓷铁一空气电池,其结构如图所示。

下列有关该电池放电时的说法正确的是( )
A.O2- 由b极移向a极
B.正极的电极反应式为FeOx+2xe-=Fe+xO2-
C.若有22.4L(标准状况)空气参与反应,则电路中有4mol 电子转移
D.铁表面发生的反应为xH2O(g)+Fe=FeOx+xH2
难度: 中等查看答案及解析
-
下列关于乙烯与苯的说法正确的是
A. 分子中均含有碳碳双键 B. 常温常压下,它们均呈气态
C. 都能使酸性KMnO4溶液褪色 D. 分子中所有原子均处于同一平面
难度: 中等查看答案及解析
-
下列试剂不能用来鉴别乙醇和乙酸的是
A.紫色石蕊试液 B.碳酸钠溶液 C.蒸馏水 D.酸性高锰酸钾溶液
难度: 中等查看答案及解析
-
一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6 +7O2+8KOH=4K2CO3+10H2O,有关此电池的推断正确的是( )
A.放电一段时间后,负极周围的pH升高
B.正极反应为14H2O+7O2+28e-=28OH-
C.每消耗1 mol C2H6 ,则电路上转移的电子为12 mol
D.放电过程中KOH的物质的量浓度不变
难度: 中等查看答案及解析
-
下列实验操作和现象与结论的关系相符的是
操作和现象
结论
A
将一小块钠分别投入盛有水和乙醇的小烧杯中,钠与乙醇反应要平缓得多
乙醇分子中的氢与水分子中的氢具有相同的活性
B
在催化剂存在的条件下,石蜡油加强热生成的气体通入溴的四氯化碳溶液中,溶液褪色
石蜡油的分解产物中含有烯烃
C
甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红
生成的氯甲烷具有酸性
D
向蔗糖溶液中加入稀硫酸,水浴加热一段时间后,再加入新制Cu(OH)2悬浊液,用酒精灯加热,未见砖红色沉淀
蔗糖未水解
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
常温下,下列溶液肯定呈酸性的是
A.含H+的溶液 B.加酚酞显无色的溶液
C.pH<7的溶液 D.c(OH―)>c(H+)的溶液
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.根据反应Cu+H2SO4
CuSO4+H2↑可推出Cu的还原性比H2的强
B.由置换反应I2+2NaClO3=2NaIO3+Cl2可知I2的氧化性强于Cl2的氧化性
C.电解含Pb(NO3)2和Cu(NO3)2的溶液,阴极上阳离子得电子次序依次是Cu2+、H+、Pb2+
D.含amolNa2S的溶液最多能吸收2.5amol的二氧化硫气体(不考虑SO2在水中的溶解)
难度: 中等查看答案及解析
-
已知锌及其化合物的性质与铝及其化合物相似。如图横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4 ]2-的物质的量浓度的对数。25℃时,下列说法中不正确的是

A. 往ZnCl2溶液中加入过量氢氧化钠溶液,反应的离子方程式为Zn2++4OH-=[Zn(OH)4]2-
B. 若要从某废液中完全沉淀Zn2+,通常可以调控该溶液的pH在8.0—12.0之间
C. pH=8.0与pH=12.0的两种废液中,Zn2+浓度之比为108
D. 该温度时,Zn(OH)2的溶度积常数(Ksp)为1×l0-10
难度: 困难查看答案及解析
-
下列有关实验的叙述正确的是

A.用图1装置将氯化铁溶液直接蒸干得到氯化铁固体
B.利用图2装置可制备Fe(OH)2
C.图3微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D.利用图4可收集氯化氢并进行尾气吸收
难度: 中等查看答案及解析
-
有关下图装置中的叙述正确的是( )

A.Pt为正极,其电极反应为:O2+2H2O +4e-=4OH-
B.这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2 沉淀的颜色
C.这是电解NaOH溶液的装置
D.Fe为阳极,其电极反应为:Fe-2e-+2OH-=2Fe(OH)2
难度: 中等查看答案及解析
-
25℃时,Ka(CH3COOH)=1.7×10-5。该温度下,用0.1mol/L的醋酸滴定10.00 mL0.1mol/L的碱MOH,滴定过程中加入醋酸的体积(V) 与溶液中lg[C(H+)/c(OH-)]的关系如图所示。下列说法正确的是

A. MOH的电离方程式为MOH
M++OH-
B. a 点:V(CH3COOH)= 10.00mL
C. b点:c(CH3COO-)>c(H+ )>c(M+)>c(OH-)
D. 25℃,时,CH3COO-的水解平衡常数为(10/17)×10-9
难度: 困难查看答案及解析