-
氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛。SOCl2遇水剧烈反应、产生白雾和带有制激性气味的气体。实验室合成SOCl2的原理为:SO2+Cl2+SCl2  2SOCl2,部分装置如图所示。
2SOCl2,部分装置如图所示。
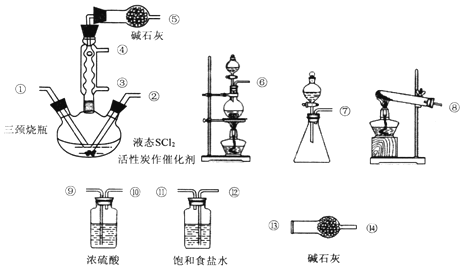
回答下列问题:
(1)仪器a 的名称是_______,装置b 的作用是__________。
(2)实验室制取SOCl2 时,所选仪器的连接顺序是⑥→______→①②←_____(某此仪器可以多次使用)。
(3)冷凝管口③是_____(填“进水”或“出水”)口,本实验中制备氯气的离子方程式为___________。
(4)将SOCl2 与AlCl3·6H2O混合加热,可得到无水AlCl3,试解释原因________。
(5)已知SCl2 的沸点为50℃。实验结束后,将三颈烧瓶中的混合物分离开的实验操作名称是___。若反应中消耗标准状况下的Cl2的体积为1120 mL,最后得到纯净的SOCl26.76 g,则SOCl2 的产率为________(保留三位有效数字)。
(6) 已知:SOCl2 +4NaOH= Na2SO3+2NaCl +2H2O。请设计简单的实验( 可选试剂:稀盐酸、稀硝酸、氯化钡溶液、硝酸钡溶液、硝酸银溶液、品红溶液) 来验证氯化亚砜与NaOH 溶液反应后的溶液中存在Cl-__________________。
-
氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、医药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并有带刺激性气味的气体产生。实验室合成原理为SO2+ Cl2+ SCl2=2SOCl2装置如下图所示。请回答以下问题:

(1)仪器A的名称是________,装置乙中盛放的试剂是______装置B的作用是____________ 。
(2)装置丁中发生反应的离子方程式为___________________________。
(3)蒸干A1C13溶液不能得到无水A1C13,使SOCl2与A1C13·6H2O混合加热,可得到无水A1C13,试解释原因:_____________________________
(4)若反应中消耗的C12的体积为896 mL(已转化为标准状况下,SCl2、SO2足量),最后得到纯净的SOCl2 4.76 g,则SOCl2的产率为________(保留三位有效数字)。
(5)常温下,将0. 01 mol SOCl2加人100 mL 0. 3 mol/L NaOH溶液中恰好完全反应,所得溶液呈__________________(填“酸”“碱”或“中”)性,溶液中所有阴离子的浓度大小顺序为________________。(已知H2SO3的 =1 .52×10-2,
=1 .52×10-2, =1.02×10-7)
=1.02×10-7)
(6)将少量SOCl2滴人5 mL 1 mol/L的AgNO3溶液中,有白色沉淀生成,该白色沉淀的成分是________________(填化学式)。
-
(1)化合物SOCl2是一种液态化合物,沸点为77℃,在盛有10mL水的锥形瓶中小心滴加8~10滴SOCl2,可观察到剧烈水解反应,液面有白雾和带有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色。轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出。
①根据上述实验,写出SOCl2和水反应的化学方程式____。
②AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3·6H2O混合共热,可得到无水AlCl3,其原因是____。
(2)25℃时,将amol/L氨水与0.01mol/L盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显__(填“酸”、“碱”或“中”)性。
(3)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中 __。
__。
[已知Ksp(BaCO3)=2.2×10–9,Ksp(BaSO4)=1.1×10–10]。
(4)次磷酸(H3PO2)是一种精细化工产品。常温下,K(H3PO2)=1×10–2,0.1mol/L的H3PO2溶液在加水稀释过程中,下列表达式的数据一定变小的是_。(填序号)
A.c(H+) B. C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.
-
(8分)化合物SOCl2是一种液态化合物,沸点为77℃,在盛有10mL的锥形瓶中小心滴加8~10滴SOCl2,可观察到剧烈水解反应,液面有白雾和带有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色.轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出.
(1)根据上述实验,写出SOCL2和水反应的化学方程式 __________.
(2)AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3·H2O 混合共热,可得到无水AlCl3,其原因是__________________________ __________________.
-
SOCl2是-种低沸点液态化合物,遇水剧烈水解生成两种气体,常用作脱水剂。某同学向盛有10mL水的锥形瓶中滴加8~10滴SOCl2,下列说法错误的是
A.锥形瓶中有白雾产生,并有刺激性气味
B.将产生气体通入紫色石蕊溶液,石蕊溶液迅速褪色
C.向反应后的溶液中滴加AgNO3溶液,产生白色沉淀
D.将AlCl3·6H2O与SOCl2混合加热可以得到无水AlCl3
-
(1)化合物SOCl2是一种液态化合物,沸点为77℃.在盛有10ml的锥形瓶中,小心地滴加8 滴~10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色.轻轻摇动锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出.
①根据上述实验,写出SOCl2与水反应的化学方式______.
②AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3•6H2O混合共热,可得无水AlCl3,其原因是______.
(2)将足量AgCl分别溶于下列试剂中形成AgCl饱和溶液,沉淀溶解平衡表示式为:
AgCl (s)⇌Ag+(aq)+Cl-(aq),AgCl的Ksp=1.76×10-10 mol2•L-2
①5ml水 ②10ml0.2 mol•L-1MgCl2 ③20ml0.5mol•L-1NaCl
④40ml0.1mol•L-1AlCl3⑤20ml0.3mol•L-1AgNO3溶解至饱和,各溶液中Ag+浓度由大到小的顺序是______,AgCl的溶解度由大到小的顺序是______.
(3)NO2可用氨水吸收生成NH4NO3.25℃时,将a mol NH4NO3溶于水,溶液显酸性、向该溶液滴加b L 氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将______(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为______mol•L-1.
(4)取等体积的0.10mol/L的NaOH溶液两份.取一份敞放在空气中一段时间后,得溶液A.另一份B密封保存.则A、B两份溶液的pH值是否相同______(填相同或不相同)用已知浓度的标准硫酸溶液,用不同的指示剂来滴定,所消耗的硫酸溶液的体积分别为VA、VB.
①若用甲基橙为指示剂时,VA与VB的关系是______;
②若用酚酞为指示剂时,VA与VB的关系是______.
-
(6分)化合物SOCl2是—种液态化合物,沸点为77℃。在盛有10mL水的锥形瓶中,小心地滴加8滴~10滴SOC12,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出。该气体可使滴有品红试液的滤纸褪色。轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出。
(1)根据上述实验,写出SOCl2和水反应的化学方程式:_________________________
(2)AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3·6H2O混合共热,可得到无水AlCl3,其原因是_________________________________________________。
-
SOCl2是一种液态化合物,沸点为77℃。有关SOCl2的实验过程如下:
Ⅰ.向盛有10mL蒸馏水的锥形瓶中,小心滴加8~10滴SOCl2,可观察到剧烈反应,液面上有雾形成,逸出有刺激性气味的气体,该气体通过含有品红的溶液时溶液褪色。
Ⅱ.轻轻振荡锥形瓶,待白雾消失后,往溶液中滴加AgNO3溶液,有白色沉淀产生,再加入HNO3,沉淀不溶解。
请回答:
(1)SOCl2与水反应的化学方程式是________________。
(2)蒸干AlCl3溶液或加热氯化铝的晶体(AlCl3·6H2O)都不能得到无水AlCl3。若使SOCl2与AlCl3·6H2O按恰当比例混合并加热,可得到无水AlCl3,原因是________。
(3)若将AlCl3溶液蒸干,得到的固体是________,继续灼烧,最终得到的固体是________。
(4)若向实验Ⅱ后的浊液中继续滴加KI溶液,现象是________,结合化学用语用平衡移动原理解释其原因________。
-
氯化物在工业生产、日常生活中应用都非常广泛。某学习小组为探究一些实用性很强的氯化物,进行了一系列的资料查询与具体实验。
(1)用于制造电池的原材料二氯亚砜(SOCl2),是一种液态化合物,沸点为77℃。在盛10mL水的锥形瓶中小心滴加8~10滴SOCl2可观察到剧烈反应,液面上形成白雾,并逸出刺激性气味的气体,该气体可使沾有品红试液的滤纸褪色。轻轻振荡锥形 瓶,待白雾消失后往溶液中滴加AgNO3溶液,有不溶于稀HNO3的白色沉淀析出。室温下,小组某同学取2.38g SOCl2与水发生上述反应,测得放出热量为17.88 kJ。根据以上实验,写出SOCl2与水反应的热化学方程式_______________________。
瓶,待白雾消失后往溶液中滴加AgNO3溶液,有不溶于稀HNO3的白色沉淀析出。室温下,小组某同学取2.38g SOCl2与水发生上述反应,测得放出热量为17.88 kJ。根据以上实验,写出SOCl2与水反应的热化学方程式_______________________。
(2)低温蒸干AlCl3溶液得到固体的主要成分是___________;小组某同学想制取无水Al Cl3固体,他提出可以用AlCl3·6H2O与SOCl2混合后共热来制取无水AlCl3固体,你认为可行吗?请说明原因______________。
Cl3固体,他提出可以用AlCl3·6H2O与SOCl2混合后共热来制取无水AlCl3固体,你认为可行吗?请说明原因______________。
(3)TiO2是一种非常好的催化剂。某同学通过查阅资料显示:TiCl4水解程度很大,可以用于TiO2的制备,制备时加入大量的水,同时加热,促进水解趋于完全,所得TiO2·xH2O经焙烧得TiO2。请写出TiCl4水解的化学方程式__________________________。
(4)某同学利用NaCl溶液设计实验验证Fe在原电池反应中的生成物,使用Cu电极、Fe电极、经过酸化的3%NaCl溶液,组成原电池装置,实验结束后,该同学往Fe电极区滴入2滴黄色铁氰化钾溶液,现象是:______________________________。
-
化合物 (
( )是一种液态化合物,沸点77 ℃,在盛有
)是一种液态化合物,沸点77 ℃,在盛有 水的锥形瓶中小心地滴加8~10滴
水的锥形瓶中小心地滴加8~10滴 ,可观察到反应剧烈,液面上有白雾形成,并逸出有气味的气体,该气体可使沾有品红试液的滤纸褪色。轻轻振荡锥形瓶,待白雾消失后往溶液中滴加
,可观察到反应剧烈,液面上有白雾形成,并逸出有气味的气体,该气体可使沾有品红试液的滤纸褪色。轻轻振荡锥形瓶,待白雾消失后往溶液中滴加 溶液,有不溶于稀硝酸的白色沉淀析出。
溶液,有不溶于稀硝酸的白色沉淀析出。
(1)根据以上实验,写出 与水反应的化学方程式:_____________________________________。
与水反应的化学方程式:_____________________________________。
(2)蒸干 溶液得不到
溶液得不到 固体,只能得到
固体,只能得到 ,所以工业上往往用
,所以工业上往往用 和
和 混合后共热来制取无水
混合后共热来制取无水 。
。
①写出蒸干 溶液过程中发生的化学反应方程式__________________________________________________。
溶液过程中发生的化学反应方程式__________________________________________________。
②写出该种制法可行性的原因:_______________________________________________,_______________________________________________________________________。(至少写出两个原因)。

=1 .52×10-2,
=1.02×10-7)
