-
0.4mol CuSO4和0.4mol NaCl溶于水,配成1L溶液,用惰性电极进行电解,当—个电极得到0.3molCu时,另一个电极上生成的气体在标准状况下的体积是
A.5.6L B.6.72L
C.1.344L D.11.2L
难度: 中等查看答案及解析
-
下列有机化合物的分类正确的是
A.
苯的同系物 B.
醇
C.
醚 D.
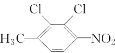 芳香烃
芳香烃难度: 中等查看答案及解析
-
下列有机物命名正确的是( )
A.
2﹣乙基丙烷
B.
3﹣丁醇
C.
邻二甲苯
D.
2﹣甲基﹣2﹣丙烯
难度: 中等查看答案及解析
-
下列离子方程式中,属于水解反应的是
A.HCOOH+H2O
HCOO−+H3O+
B.CO32-+2H2O
H2CO3+2OH-
C.Fe3++3H2O
Fe(OH)3↓+3H+
D.HS-+H2O
H2S+OH-
难度: 简单查看答案及解析
-
少量铁片与100 mL 0.01 mol·L-1的稀盐酸反应(盐酸过量),反应速率太慢。为了加快此反应速率而不改变H2的产量,如下方法中的成立的是
A.加入少量铁粉
B.加NaCl溶液
C.滴入几滴硫酸铜溶液
D.改用10 mL 0.1 mol·L-1盐酸
难度: 简单查看答案及解析
-
可逆反应A(s)+B(g)
2C(g) △H<0在密闭容器中达到平衡后,改变条件,能使B转化率提高的是( )
A. 保持温度不变,减小压强 B. 保持恒温恒容,充入氦气
C. 其它条件不变时,升高温度 D. 其它条件不变时,加入少量A
难度: 中等查看答案及解析
-
为提纯下列物质括号内为杂质,除杂试剂和分离方法都正确的是
序号
不纯物
除杂试剂
分离方法
A
CH4(乙烯)
酸性KMnO4溶液
洗气
B
己烯(苯)
溴水
分液
C
溴苯(液溴)
乙醇
分液
D
C2H5OH(H2O)
新制生石灰
蒸馏
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
一定条件下,下列反应不可能自发进行的是
A.2O3(g)=3O2(g) △H<0
B.CaCO3(s)=CaO( s)+ CO2(g) △H>0
C.N2(g) +3H2(g)
2NH3(g) △H<0
D.2CO(g)=2C(s)+ O2(g) △H>0
难度: 简单查看答案及解析
-
分子式为C3H6BrCl的有机物共有(不含立体异构)
A. 4种 B. 5种 C. 6种 D. 7种
难度: 中等查看答案及解析
-
利用下图所示装置可以模拟铁的电化学腐蚀。下列说法中,正确的是
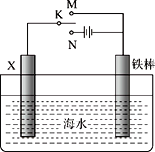
A.若X为碳棒,开关K置于M处可以减缓铁的腐蚀
B.若X为铜棒,开关K置于N处可以加快铁的腐蚀
C.若X为碳棒,开关K置于M处,则为牺牲阳极的阴极保护法
D.若X为碳棒,开关K置于N处,则为外加电流的阴极保护法
难度: 中等查看答案及解析
-
下列有关化工生产的说法中错误的是
① 可以电解饱和食盐水来制取金属钠
② 可以将钠加入MgCl2饱和溶液中制取镁
③ 用电解法冶炼铝时,原料是氯化铝
④ 冶炼金属时,必须加入一种物质作为还原剂
⑤ 在金属铁表面镀上一层铜,让铁作电解池的阴极,溶液中铜离子浓度可保持不变
⑥ 电解精炼铜时,若硫酸铜溶液为电解液,则粗铜作阳极,溶液中铜离子浓度始终保持不变
A.② ③ B.① ④ ⑤ C.① ② ③ ④ ⑥ D.① ② ③ ④ ⑤ ⑥
难度: 简单查看答案及解析
-
下列说法能说明醋酸为弱酸的有
①0.1 mol·L-1CH3COOH溶液pH约为2.3
②0.1 mol·L-1 CH3COOH溶液的导电能力比相同条件下盐酸的弱
③相同条件下,把锌粒投入等浓度的盐酸和醋酸中,前者反应速率比后者快
④醋酸溶液中滴入石蕊试液变红,再加CH3COONH4固体,红色变浅
⑤常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合溶液呈酸性
⑥常温下,CH3COONa水溶液的pH>7
A.①②③④⑤⑥ B.①②⑥ C.③④⑤ D.①②③⑤⑥
难度: 简单查看答案及解析
-
标准状况下,两种气态烃的混合物共2.24L,完全燃烧后得3.36L二氧化碳和3.6g的水,则混合气体中
A.一定含有甲烷
B.一定含有乙烯
C.可能含有乙炔
D.一定是由烷烃和烯烃构成
难度: 简单查看答案及解析
-
下列与盐类水解知识有关的有几项
① 实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞
② 施肥时,草木灰(有效成分为K2CO3)不能与碳酸氢铵混合使用
③ Al2S3不能用复分解反应的方法在溶液中制取,而只能用干法制备
④ 配制FeCl2溶液时常常要在溶液中加入少量铁粉
⑤ 金属焊接时可用NH4Cl溶液作除锈剂
⑥ 使用泡沫灭火器灭火的原理
⑦ 明矾 [KAl(SO4)2·12 H2O]可用于净水
⑧ 加热蒸干MgCl2溶液获得无水MgCl2,需要在HCl气流中进行
⑨ 误将钡盐[BaCl2、Ba(NO3)2]当作食盐混用后,常用0.5%的Na2SO4溶液解毒
⑩ 溶洞、珊瑚的形成
A.4项 B.5项 C.6项 D.7项
难度: 简单查看答案及解析
-
在一定体积的密闭容器中,进行如下的化学反应CO2(g)+H2(g)
CO(g)+H2O(g),其化学平衡常数K和温度的关系如下表,根据信息推断以下说法正确的是
t/℃
700
800
830
1000
1200
K
0.6
0.9
1.0
1.7
2.6
A.此反应为放热反应
B.此反应只有达到平衡时,密闭容器中的压强才不会变化
C.830℃时,反应物CO2与H2按1:1投料,平衡时H2的转化率为50%
D.该反应的化学平衡常数越大,反应物的转化率越低
难度: 简单查看答案及解析
-
向某密闭容器中充入 1 mol X 与 2 mol Y 发生反应:X(g)+2Y(g)
aZ(g) H<0,达到平衡后,改变某一条件(温度或容器体积),X 的平衡转化率的变化如图所示。下列说法中正确的是( )
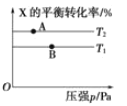
A.a=2
B.T2>T1
C.A 点的反应速率:3v 正(X)=v 逆(Z)
D.用 Y 表示 A、B 两点的反应速率:v(A)>v(B)
难度: 中等查看答案及解析
-
将0.2mol·L-1HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是( )
A.c(HCN)<c(CN-) B.c(Na+)<c(CN-)
C.c(HCN)-c(CN-)=c(OH-) D.c(HCN)+c(CN-)=0.1mol·L-1
难度: 中等查看答案及解析
-
锌–空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH-+2H2O
2Zn(OH)42-。下列说法正确的是
A.充电时,电路中每通过1mol电子,电解质溶液中就有0.5mol K+向阳极移动
B.充电时,电解质溶液中c(OH-) 逐渐减小
C.放电时,负极反应为:Zn+4OH--2e–=Zn(OH)42-
D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
难度: 简单查看答案及解析
-
现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽。用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中正确的是( )

A.b是阳离子交换膜,允许Na+通过
B.从A口出来的是NaOH溶液
C.阴极反应式为4OH--4e-= 2H2O+O2↑
D.Na2SO4溶液从G口加入
难度: 中等查看答案及解析
-
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)
NH3(g)+HI(g);②2HI(g)
H2(g)+HI(g)
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下,反应①的平衡常数为
A.9 B.16 C.20 D.25
难度: 中等查看答案及解析
-
在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10 mol2·L-2,下列说法不正确的是

A.在t ℃时,AgBr的Ksp为4.9×10-13 mol2·L-2
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由b点到c点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)
AgBr(s)+Cl-(aq)的平衡常数K≈816
难度: 简单查看答案及解析
-
在25mL 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是
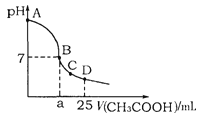
A.在A、B间任一点(不含A、B点),溶液中可能有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在D点,c(CH3COO-)+c(CH3COOH)=c(Na+)
难度: 中等查看答案及解析
 中官能团的名称为_________________;
中官能团的名称为_________________;